1、填空题 减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
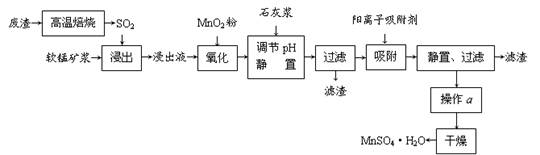
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
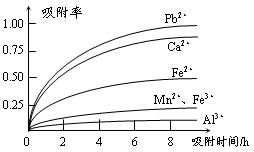
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子
| 离子半径(pm)
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 74
| 7.6
| 9.7
|
Fe3+
| 64
| 2.7
| 3.7
|
Al3+
| 50
| 3.8
| 4.7
|
Mn2+
| 80
| 8.3
| 9.8
|
Pb2+
| 121
| 8.0
| 8.8
|
Ca2+
| 99
| -
| -
|
?
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式?,氧化过程中主要反应的离子方程式?。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至?。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是?(填写序号)。
a.溶液的pH?b.金属离子的电荷?c.金属离子的半径?d.吸附时间
⑷ 操作a包括?等过程。
参考答案:
⑴ SO2+MnO2=MnSO4?2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
⑵ 4.7~8.3
⑶ b c d
⑷ 蒸发浓缩结晶
本题解析:
本题以制备硫酸锰的生产流程为知识载体,考查化学反应的书写,及除杂中的问题。(1)从流程图看,浸出过程是软锰矿浆(MnO2)与SO2的反应。杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+。(2)杂质中含有Fe2+、Al3+、Ca2+、Pb2+四种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂。从吸附率的图可以看出,Ca2+、Pb2+的吸附率较高,故只要调节pH值在4.7~8.3间,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀。(3)结合半径,分析右图知,图中离子从上至下,半径有减小趋势,对应的吸附率减小。随着时间的递增,所有离子的吸附率均增大;另Fe3+和Al3+离子所带电荷数大,其吸附率低。(4)由于制取的MnSO4·H2O含有结晶水,故采用蒸发浓缩结晶的方法。
本题难度:一般
2、填空题 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:


已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为? 。若要计算该溶液的质量分数,
还需要的一个条件是 ? (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 ?。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是
否过量的简单实验方法是?。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 ? (选填序号)。
a.Na2O2? b.Na2S? c.FeCl2?
(6)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏? b.蒸发? c.灼烧? d.过滤? e.冷却结晶
要得到更纯的NaClO2?3H2O晶体必须进行的操作是 ? (填操作名称)。
参考答案:
(1)①4mol/L(1分,未写单位不给分),该溶液的密度(1分);
(2)b(2分);
(3)2NaOH+2ClO2+H2O2→2NaClO2+2H2O2+O2(2分);防止H2O2分解(1分);
(4)连续测定吸收塔内溶液的pH值(2分);(5)a (1分);
(6)b、e、d(2分);重结晶(1分)
本题解析:略
本题难度:简单
3、选择题 下列过程合乎实际并用于工业生产的是(?)
A.钠在氯气中燃烧制氯化钠
B.氯化铵与氢氧化钙共热制氨气
C.浓盐酸与二氧化锰共热制氯气
D.氯气与石灰乳反应制漂白粉
参考答案:D
本题解析:略
本题难度:简单
4、实验题 工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果。实现了废水处理过程的“三废”零排放。其主要工艺流程如下:
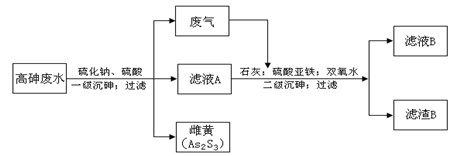
已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为?,通过与石灰发生?反应(填基本反应 类型)被吸收。
类型)被吸收。
(2)写出一级沉砷过程中生成雌黄的离子方程式:?。
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质?。
(4)二级沉砷过程中使用双氧水的目的有?。
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:?
(6)滤渣B的主要成分有?(写两种,用化学式表示)。
参考答案:(10分)(每空2分)
(1)H2S;中和反应(或复分解反应) 2分
(2)2H3AsO3+3S2-+6H+→As2S3↓+6H2O
(或 2H3AsO3+3S2-→As2S3↓+6OH-;H++OH-→H2O)(2分)
(3)H3AsO3(2分)
(4)A B C(少1个选项扣1分,直至扣完)(2分)
(5)漏斗、烧杯、玻璃棒(2分)
(6)FeAsO4 、Ca3(AsO4)2 、Ca3(AsO3)2、Fe(OH) 3 、CaSO4等(合理答案均给2分)
本题解析:略
本题难度:一般
5、选择题 为中国近代化学发展做出突出贡献的科学家是
A.李四光
B.华罗更
C.候德榜
D.钱学森
参考答案:B
本题解析:题述四个选项中的科学家均为我国科学事业的发展做出了突出的贡献。其中,李四光是我国当代著名的地质学家;华罗更是著名的数学家;钱学森是著名的物理学家;候德榜被称为中国近代化学史上的第一颗明星,为中国化学工业发展做出卓越贡献,是中国近代化工工业的奠基人,他发明的联合制碱法为中华民族争得了荣誉。
本题难度:简单