1、选择题 下表是元素周期表的一部分,有关说法正确的是?(?)
?
| IA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
2
| ?
| ?
| ?
| c
| ?
| d
| ?
|
3
| a
| b
| ?
| ?
| ?
| e
| f
|
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
参考答案:D
本题解析:a、b、c、d、e、f六种元素分别为:Na、Mg、C、O、S、Cl;
本题难度:一般
2、选择题 下列叙述正确的是
A.直径介于1 nm ~ 100 nm之间的微粒称为胶体
B.电泳现象可证明胶体带电
C.用渗析的方法可以除去淀粉溶液中的氯化钠
D.用含1 mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子
参考答案:C
本题解析:
本题难度:一般
3、选择题 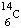 在考古学和医学上有着广泛用途,下列有关
在考古学和医学上有着广泛用途,下列有关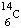 的说法中正确的是
的说法中正确的是
A.质子数为14
B.中子数为6
C.质量数为8
D.电子数为6
参考答案:D
本题解析:略
本题难度:简单
4、选择题 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
参考答案:B
本题解析:因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y2->Z-,故B正确;
C、氢化物稳定性应为HZ>H2Y,故C错误;
D、原子半径大小关系应为X>W,故D错误;
故选B。
点评:本题通过四种电子层结构相同的粒子考查学生对原子(离子)结构、元素周期律、氧化还原等知识的掌握情况,同时也要求学生平时应善于对知识进行归纳总结并变通应用。
本题难度:一般
5、计算题 ( 13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
A
| ?
| ?
|
?
| ?
| ?
| ?
| M
| Q
| R
| ?
| ?
|
?
| ?
| E
| ?
| ?
| ?
| D
| ?
|
?
| ?
| ?
| G
| ?
| ?
| ?
| J
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| 91eXAm.org?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有?个。该晶体属于?晶体
A .离子晶体? B . 原子晶体? C . 分子晶体? D. 金属晶体
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种?分子(填极性或非极性)。
(3)请写出D-的电子排布式:?。
(4)M2A2也是直线型分子,1个分子中含有?个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式。(用元素符号表示)
参考答案:(1)8?D?(2)非极性?(3)1s22s22p63s23p6?(4)3
(5)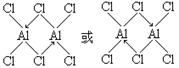
本题解析:根据元素在周期表中是位置可知:A是H;M是C;Q是N;R是O;E是Al;D是Cl;G是Ti;J是Fe。(1)Ti和Fe形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。因为在氯化铯晶体中,每个Cs+离子周围与其距离相等且最近的Cl-有8个。使用该合金中每个G原子周围与其最近且等距的J原子有8个。该晶体是合金,属于金属晶体。选项为D。(2)C3O2是一种直线型分子O=C=C=C=O,。由于该分子的空间排列是对称的。所以该分子是一种非极性分子。(3)在Cl-的核外有18个电子。其电子排布式:1s22s22p63s23p6。(4)C2H2也是直线型分子,1个分子中含有3个σ键。(5)在化合物Al2Cl6分子中各原子均达到了八电子稳定结构,其结构式是 。
。
本题难度:一般