|
高中化学知识点大全《化学反应速率》考点强化练习(2017年押题版)(十)
2018-03-17 05:59:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列改变一定会加快反应速率的是( )
A.增加反应物量
B.压强增大
C.升高温度
D.光照
|
参考答案:C
本题解析:考查外界条件对反应速率的影响,改变浓度,可以改变反应速率,改变质量不一定。压强只能适用于有气体参加的反应,B不正确,同样光照也不一定改变反应速率,所以答案选C。
本题难度:一般
2、填空题 (14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为?。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式?。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
| 初始投料
| 2 mol A2、1 mol BC
| 1 mol X
| 4 mol A2、2 mol BC
| 平衡时n(X)
| 0.5 mol
| n2
| n3
| 反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
| 体系的压强
| P1
| P2
| P3
| 反应物的转化率
|  1 1
|  2 2
|  3 3
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率
v (A2)=?。
② 计算该温度下此反应的平衡常数K =?。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是?(填字母)。
A.α1+α2=1? B.Q1+Q2=Q? C.α3<α1?
D.P3<2P1=2P2? E.n2<n3<1.0 mol? F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。

⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。

参考答案:⑴离子键、极性键(或共价键)
⑵ H2(g)+Cl2(g)=2HCl(g)?H=(a+b-2c)kJ·mol-1[?H表示成-(2c-a-b)kJ·mol-1也可]
⑶①0.125 mol·L-1·min-1
②4 L2/mol2?③ ABD
④

⑷ O2+4e-+2CO2=2CO32-
本题解析:根据题意依次推出A为氢元素,B为碳元素,C为氧元素,D为钠元素,E为氯元素;
⑴A、C、D形成的化合物为NaOH,其所含化学键为离子键、极性键(或共价键);
⑵首先写出A2与E2反应的方程式,并标出各物质的状态为H2(g)+Cl2(g)=2HCl(g);将“①-②+③×2”得该化学方程式,根据盖斯定律得该反应热?H=(a+b-2c)kJ·mol-1,据此便可写出完整的热化学方程式;
⑶①A2的平均反应速率v (A2)= ; ;
②该温度下此反应的平衡常数K= ; ;
③甲和乙两容器的平衡状态为全等平衡,则有α1+α2=1,Q1+Q2=Q,P1=P2,n2=n1=0.5 mol;由于丙容器的起始量是甲的2倍,可将丙容器的体积扩大2倍(与甲同压等效),然后再恢复到原体积,则可得α3>α1,P3<2P1,n2<1.0 mol<n3,Q3>2Q1,综上只有A、B、D项正确。
④第5min时X的物质的量浓度变为0.5 mol/L(体积变为1 L),再根据“第8min达到新的平衡时A2的总转化率为75%”,则到新平衡时X的物质的量浓度为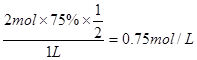 ,据此便可作图。 ,据此便可作图。
⑷O2在正极上发生还原反应生成CO32-:O2+4e-+2CO2=2CO32-。
本题难度:一般
3、选择题 将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应: NH4Br(s)  NH3(g)+HBr(g)? 2HBr(g) NH3(g)+HBr(g)? 2HBr(g)  Br2(g)+H2(g) 。2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用 Br2(g)+H2(g) 。2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用 (NH3)表示,下列反应速率正确的是 (NH3)表示,下列反应速率正确的是
A.0.5mol/(L·min)
B.2.5 mol/(L·min)
C.2 mol/(L·min)
D.5 mol/(L·min)
参考答案:B
本题解析:对于2HBr(g)  Br2(g)+H2(g),c(H2)=0.5mol/L,可知分解的HBr的浓度为1mol/L;而平衡时容器内的HBr的浓度为4mol/L,故NH4Br分解出的HBr的浓度为5mol/L,也就是说容器中NH3的浓度为5mol/L:υ(NH3)="5" mol/L/2min="2.5" mol/(L·min) Br2(g)+H2(g),c(H2)=0.5mol/L,可知分解的HBr的浓度为1mol/L;而平衡时容器内的HBr的浓度为4mol/L,故NH4Br分解出的HBr的浓度为5mol/L,也就是说容器中NH3的浓度为5mol/L:υ(NH3)="5" mol/L/2min="2.5" mol/(L·min)
本题难度:一般
4、填空题 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断______段化学反应速率最快,______段收集的氢气最多.
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是______,一定时间后反应速率逐渐减慢,其原因是______.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是______
A.蒸馏水?B.氯化钠固体?C.氯化钠溶液?D.浓盐酸?E.降低温度
(4)EF段产生H2的反应速率为______mL?min-1.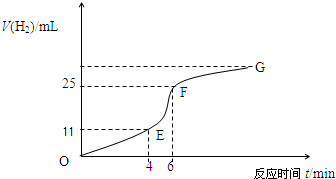
参考答案:(1)根据纵坐标的高低判断收集气体的多少,纵坐标越高,收集的气体越大,所以是EF段;根据图象斜率判断反应速率的大小,斜率越大,反应速率越快,所以是EF段,故答案为:EF段;EF段;
(2)影响EF段速率变化主要因素是:该反应是放热反应,温度越高,反应速率越快,所以温度的改变是改变反应速率的主要原因;影响FG段速率变化主要因素是:随着反应的进行,盐酸的浓度逐渐减小,浓度越小,反应速率越小,所以浓度的改变是改变反应速率的主要原因;
故答案为:该反应是放热反应,温度升高,反应速率加快;随着反应的进行,盐酸的浓度逐渐减小,反应速率逐渐减小.
(3)反应物的浓度越大,反应速率越快,所以只要使反应物浓度变小即可.
A、加蒸馏水,盐酸浓度变小,反应速率减小,故A正确;
B、加氯化钠固体,盐酸浓度不变,反应速率不变,故B错误;
C、加氯化钠溶液,溶液体积增大,盐酸浓度降低,反应速率减小,故C正确;
D、加浓盐酸,盐酸浓度增大,反应速率加快,故D错误;
E、温度降低,化学反应速率减小,故E正确;
故答案为:ACE;
(3)因V=△V△t=14ml2min=7.0ml?min-1,故答案为:7.0.
本题解析:
本题难度:一般
5、选择题 反应C(s)+H2O(g)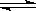 CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是 CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是
A.压缩容器体积,增大体系压强
B.加入适当的催化剂
C.保持压强不变,充入惰性气体使容器容积增大
D.保持容器容积不变,充入惰性气体使体系压强增大
参考答案:D
本题解析:A、压缩容器体积,增大体系压强,化学反应速率加快,错误;B、加入适当的催化剂化学,反应速率加快,错误;C、保持压强不变,充入惰性气体使容器容积增大,反应物浓度减小,反应速率减慢,错误;D、保持容器容积不变,充入惰性气体使体系压强增大,但气体的浓度均未改变,所以反应速率不变,正确,答案选D。
本题难度:一般
| 
