1、实验题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
序号
| 条件
| 现象
| 结论
|
温度/℃
| 催化剂
|
1
| 40
| FeCl3溶液
| ?
| ?
|
2
| 20
| FeCl3溶液
| ?
| ?
|
3
| 20
| MnO2
| ?
| ?
|
4
| 20
| 无
| ?
| ?
|
试回答:
①实验1、2研究的是?对H2O2分解速率的影响。
②实验2、3的目的是?。?
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________。
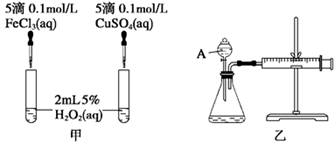
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是?。
(3)实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是?。
A、硫酸钾? B、硫酸锰? C、水? D、氯化锰
2、选择题 下列说法错误的是(?)
A.固体颗粒大小也会影响反应速率
B.温度越高反应速率也越大
C.加入催化剂一定能加快反应速率
D.反应速率主要由反应物性质决定
3、选择题 下列有关化学概念或原理的论述中,正确的是
A.任何一个氧化还原反应都可以设计为电池,输出电能
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.电解饱和食盐水的过程中,水的电离平衡正向移动
D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大
4、选择题 在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)?4C(g)+5D(g),若经5秒钟后,剩下的A是2.5mol,则B的反应速率是( )
A.0.45mol/(L?s)
B.0.15mol/(L?s)
C.0.225mol/(L?s)
D.0.9mol/(L?s)
5、选择题 能增加反应物分子的活化分子的百分数,同时可以改变转化率的是
A.升高温度
B.使用催化剂
C.增大压强
D.增加浓度