1、选择题 某元素的3p能级上有两个未成对电子,因此其?(?)
A.第三电子层上有4个电子
B.最高正价为+2
C.最高正价为+4
D.第二电子层没有未成对电子
参考答案:D
本题解析:由于3p能级上已有两个未成对电子,所以该原子的核外电子排布为1s22s22p63s23p2或1s22s22p63s23p4,故D正确。
本题难度:一般
2、选择题 下列说法中正确的是:
A.在周期表中,主族元素所在的族序数等于原子核外电子数
B.最外层电子数为8的不一定是稀有气体元素的原子
C.元素的原子序数越大,其原子半径越大
D.键能越大 ,表示该分子越容易受热分解
,表示该分子越容易受热分解
参考答案:D
本题解析:略
本题难度:简单
3、填空题 Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
(1)写出基态原子或离子的电子排布式:
Fe3+_________________;Cu _______________。
(2)比较 Fe2+与Fe3+的化学稳定性:Fe2+?Fe3+;半径大小:Fe2+?Fe3+(均填“>”或“<”)。
Ⅱ.(1)在第三周期中,第一电离能最小的元素是______,电负性最大的元素是_______(用元素符号表示)。
(2)第三周期原子中p轨道半充满的元素是_______?(用元素符号表示)。
(3)第二周期原子中,未成对电子数等于其周期序数的原子有?(用元素符号表示)。
Ⅲ.酞菁与酞菁铜染料分子结构如下图:酞菁分子中氮原子采用的杂化方式有:?,并在下图相应位置上标出酞菁铜结构中铜原子周围的配位键: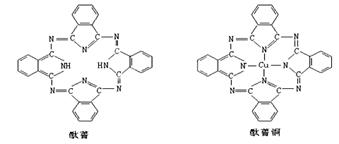
参考答案:(10分)Ⅰ.(1)1s22s22p63s23p63d5(1分)? 1s22s22p63s23p63d104s1(1分)
(2)< (1分) ,>(1分)
Ⅱ.(1)Na (1分),Cl(1分)(2)P(1分)(3)C和O(1分,少一个不给分)
Ⅲ.sp2和sp3(1分,少一个不给分) (1分)
(1分)
本题解析:Ⅰ.(1)共计构造原理可知,铁离子和铜原子的电子排布式分别是1s22s22p63s23p63d5、1s22s22p63s23p63d104s1。
(2)铁离子的3d轨道电子处于半充满状态,所以稳定性强于亚铁离子的。但亚铁离子的半径大于铁离子的。
Ⅱ.(1)金属性越强,第一电离能越小,则在第三周期中,第一电离能最小的元素是Na。非金属性越强,电负性越大,所以在第三周期元素中电负性最大的元素是。
(2)根据核外电子排布可知,在第三周期原子中p轨道半充满的元素是P。
(3)据核外电子排布可知,第二周期原子中,未成对电子数等于其周期序数的原子有C和O。
Ⅲ.酞菁分子中部分氮原子含有2个σ键、一个孤对电子,所以采取sp2杂化,部分氮原子含有3个σ键、一个孤对电子,所以采取sp3杂化。由于氮原子含有孤对电子,而铜原子含有空轨道,所以二者可以形成配位健。
点评:该题是高考中的常见题型,属于基础性试题的考查。主要是考查学生灵活运用基础知识解决实际问题的能力,有助于提高学生的应试能力和学习效率。
本题难度:一般
4、选择题 下列说法正确的是
A.酸性氧化物在常温下均呈气态
B.元素的非金属性越强,对应离子的还原性也越强
C.非金属元素间相互结合形成的化合物一定是共价化合物
D.共价化合物的分子中一定不含离子键
参考答案:D
本题解析:A错,酸性氧化物在常温下可以是气态,如二氧化碳;可以是固态,如二氧化硅;可以是液态,如三氧化硫;
B错,元素的非金属性越强,对应离子的还原性越弱;C错,如铵盐;D正确,共价化合物的分子中一定不含离子键,有离子键的化合物一定是离子化合物。
本题难度:一般
5、选择题 有关叙述:①非金属单质M能从N的化合物中置换出非金属单质N
②M原子比N原子容易得到电子。?③单质M跟H2反应比N跟H2反应容易得多
④气态氢化物水溶液的酸性HmM>HnN。⑤氧化物水化物的酸性HmMOx>HnNOy。?⑥熔点M>N
能说明M比N的非金属性强的叙述是(?)
A.①②③
B.②⑤
C.①②③④⑤
D.全部
参考答案:A
本题解析:本题需要熟记元素非金属性的强弱比较标准。
本题难度:简单