1、填空题
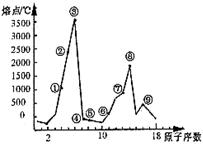
(1) ③号元素位于周期表第____周期第_____族,其单质的一种同素异形体能导电,该同素异形体的名称叫________
⑵④号元素形成的气态氢化物的电子式为__________,属于_____分子(填极性或非极性)
⑶⑥、⑦两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________
⑷⑨号元素的原子结构示意图为_______________________。⑨与⑤两种元素形成的一种化合物是污染大气的主要有害物质之一,它对环境的危害主要是:?
参考答案:⑴ 二ⅣA石墨⑵ 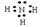 极性⑶Al(OH)3+OH-=AlO2-+2H2O⑷
极性⑶Al(OH)3+OH-=AlO2-+2H2O⑷ 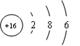 形成酸雨等
形成酸雨等
本题解析:本题主要考查了有关元素周期表、元素周期律的相关知识,起点高落点低,属中等难度题。关键是要将图和元素周期表、元素周期律相结合起来考虑。由图中横坐标为原子序数容易找出各序号对应的元素,然后结合各元素具体性质予以解答。
本题难度:一般
2、选择题 按能量由低到高的顺序排列,正确的一组是? (? )
A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3p
参考答案:C
本题解析:原子轨道能量的高低(也称能级)主要由主量子数n和角量子数l决定。当l相同时,n越大,原子轨道能量E越高,例如E1s<E2s<E3s;E2p<E3p<E4p。当n相同时,l越大,能级也越高,如E3s<E3p<E3d。故C正确
点评:本题主要考察能级能量大小的比较,属于简单题,掌握从低能级到高能级,电子能量逐渐增大是解题的关键。
本题难度:简单
3、选择题 不符合原子核外电子排布基本规律的是?
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
参考答案:D
本题解析:A.核外电子总是首先排布在离核近、能量低的电子层上,故A正确;
B.K层离原子核最近,能量最低,故B正确;
C.N层最多可以排布2×42个电子,为最外层是最多排8个,为次外层时最多排18个,故C正确;
D.各电子层(n)最多可容纳的电子数为2n2故D错误;
故选A。
点评:本题考查了原子核外电子排布的规律,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:一般
4、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/10-12 m
| 160
| 110
| 70
| 66
|
主要化合价
| +2
| +5、+3、-3
| +5、+3、-3
| -2
|
?
下列叙述正确的是( )
A.离子半径:W2-<X2+
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
参考答案:D
本题解析:从化合价判定X是ⅡA族元素,Y、Z是ⅤA族元素,W是氧元素,再结合原子半径:X是Mg,Y是P,Z是N。O2-与Mg2+核外电子排布相同,Mg2+核电荷数大,半径小,A错;非金属性O>N,稳定性H2O>NH3,B选项错;化合物Mg3N2中只存在离子键,C选项错;酸性HNO3>H3PO4,D选项正确。
本题难度:简单
5、选择题 与Na+具有相同电子数和质子数的微粒是(?)
A.NH4+
B.F-
C.NH3
D.OH-
参考答案:A
本题解析:根据钠的原子序数为11,则Na+具有11个质子数,因原子变为阳离子要失去电子,则电子数为10,然后判断选项来分析解答。
A、NH4+中具有11个质子数和10个电子,则与Na+具有相同质子数和电子数,故A正确;
B、F-中有9个质子和10个电子,则不与Na+具有相同质子数和电子数,故B错误;
C、NH3中有10个质子和10个电子,而Na+具有11个质子数和10个电子,故C错误;
D、OH-中具有9个质子和10个电子,则不与Na+具有相同质子数和电子数,故D错误;
故选A。
点评:题考查微粒中的质子数和电子数,学生应注意中性微粒质子数等于电子数,离子中质子数=电子数±电荷数。
本题难度:一般