1、选择题 欲迅速除去水壶底的水垢,又不损坏铝壶,最好选用( )
A.浓盐酸
B.稀硝酸
C.冷的浓硫酸
D.冷的浓硝酸
参考答案:A、浓盐酸可以溶解CaCO3和Mg(OH)2,能与铝反应,损坏铝壶,故A错误;
B、稀硝酸可以溶解CaCO3和Mg(OH)2,能与铝反应,损坏铝壶,故B错误;
C、铝在冷的浓硫酸中发生钝化,但硫酸钙微溶,生成的硫酸钙为附着在水垢上,阻止反应继续进行,故C错误;
D、冷的浓硝酸与CaCO3和Mg(OH)2反应,生成可溶的硝酸钙、硝酸镁,除去水垢,且铝在冷的浓硝酸中发生钝化,不损坏铝壶,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 下列实验操作能达到预期实验目的的是
?
| 实验目的
| 实验操作
|
A
| 鉴别Al3+和Fe3+
| 分别加入过量NaOH溶液
|
B
| 比较Fe和Cu的金属活动性
| 分别加入浓硝酸
|
C
| 证明品红溶液褪色的原因是通入了SO2
| 将褪色后的溶液再加热
|
D
| 分离乙酸乙酯和乙酸
| 加饱和NaOH溶液,蒸馏
参考答案:AC
本题解析:A.氢氧化铝溶于过量的氢氧化钠溶液,而氢氧化铁不溶,正确;B.铁在浓硝酸中会发生钝化现象,而铜会与浓硝酸反应,应该选用稀硫酸才合理,错误;C.二氧化硫使品红褪色的原理是生成了无色不稳定的物质,当受热后又会分解,恢复原来的颜色,正确;D.乙酸乙酯在氢氧化钠溶液中会水解,联系课本实验乙酸乙酯的制备可知,当选用饱和的碳酸钠溶液,错误。
本题难度:一般
3、填空题 硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
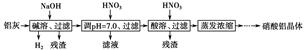
已知:Al(OH)3沉淀和溶解的pH如下表:
Al(OH)3
| 开始沉淀
| 沉淀完全
| 沉淀开始溶解
| 沉淀溶解完全
| pH
| 3.3
| 5.0
| 7.8
| 12.8
|
?
回答下列问题:
(1)碱溶时,发生主反应的离子方程式为________________________________。
(2)工艺流程中第一次加入硝酸调pH=7.0的目的是__________________________________________________________。
pH=7.0时,溶液中c(Al3+)=________(通常条件下,Ksp[Al(OH)3]=1.3×10-33)。
(3)若忽略杂质跟酸、碱的反应,则在碱溶、调pH=7.0、酸溶过程中,理论上消耗碱、酸的物质的量之比n1(NaOH)∶n2(HNO3)∶n3(HNO3)=________。
(4)现用1 t铝灰制硝酸铝晶体[Al(NO3)3·9H2O],最后生产出7.5 t硝酸铝晶体,若生产过程中铝元素的损失率为10%,计算铝灰中铝元素的质量分数。
参考答案:(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)使Al(OH)3沉淀完全 1.3×10-12 mol·L-1
(3)1∶1∶3
(4)60%
本题解析:(1)注意铝灰的主要成分为Al,主要反应是铝与碱的反应。(2)结合流程图可知,调节pH=7.0时,过滤得到的沉淀再加HNO3,得硝酸铝,可知沉淀为Al(OH)3。c(Al3+)=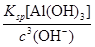 =1.3×10-12 mol·L-1。(3)碱溶、调pH=7.0、酸溶的反应分别为:2Al+2OH-+2H2O=2AlO2-+3H2↑、AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,得n1(NaOH)∶n2(HNO3)∶n3(HNO3)=1∶1∶3。 =1.3×10-12 mol·L-1。(3)碱溶、调pH=7.0、酸溶的反应分别为:2Al+2OH-+2H2O=2AlO2-+3H2↑、AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,得n1(NaOH)∶n2(HNO3)∶n3(HNO3)=1∶1∶3。
(4)设铝元素的质量分数为x
Al ~ Al(NO3)3·9H2O
27 375
1 t×(1-10%)×x 7.5 t
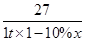 = =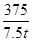
解得:x=0.6(或60%)
本题难度:一般
4、选择题 氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的
[? ]
A. 酸性
B. 碱性
C. 两性
D. 氧化性
参考答案:B
本题解析:
本题难度:简单
5、选择题 某混合溶液中含有MgCl2的浓度为2 mol·L-1,含AlCl3的浓度为3 mol·L-1,将此溶液200 mL中Mg2+转化为Mg(OH)2沉淀分离出来,至少需要1.6 mol·L-1的NaOH溶液的体积是(?)
A.3.2 L
B.2 L
C.1.5 L
D.1.8 L
参考答案:B
本题解析:此题可用常规做法用反应方程式综合计算,也可整体思考利用质量守恒、电荷守恒直接计算。
由题意可知:Mg2+转化为Mg(OH)2沉淀分离出来,Al3+完全转化为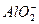 ,溶液中的离子为Na+、 ,溶液中的离子为Na+、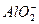 、Cl-,由质量及电荷守恒易得:n(Na+)=n( 、Cl-,由质量及电荷守恒易得:n(Na+)=n(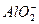 )+n(Cl-)="0.6" mol+(0.8 mol+1.8 mol)="3.2" mol,V(NaOH)="3.2" mol÷1.6 mol·L-1="2" L。 )+n(Cl-)="0.6" mol+(0.8 mol+1.8 mol)="3.2" mol,V(NaOH)="3.2" mol÷1.6 mol·L-1="2" L。
本题难度:简单
|