1、选择题 欲迅速除去水壶底的水垢,又不损坏铝壶,最好选用( )
A.浓盐酸
B.稀硝酸
C.冷的浓硫酸
D.冷的浓硝酸
2、选择题 下列实验操作能达到预期实验目的的是
?
| 实验目的
| 实验操作
|
A
| 鉴别Al3+和Fe3+
| 分别加入过量NaOH溶液
|
B
| 比较Fe和Cu的金属活动性
| 分别加入浓硝酸
|
C
| 证明品红溶液褪色的原因是通入了SO2
| 将褪色后的溶液再加热
|
D
| 分离乙酸乙酯和乙酸
| 加饱和NaOH溶液,蒸馏
3、填空题 硝酸铝广泛用于有机合成、印染工业等。工业上以铝灰为原料(主要成分为Al,含少量Al2O3、Fe2O3、SiO2、CaO、MgO等)制备硝酸铝的工艺流程如下:
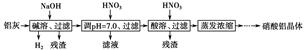
已知:Al(OH)3沉淀和溶解的pH如下表:
Al(OH)3
| 开始沉淀
| 沉淀完全
| 沉淀开始溶解
| 沉淀溶解完全
| pH
| 3.3
| 5.0
| 7.8
| 12.8
|
?
回答下列问题:
(1)碱溶时,发生主反应的离子方程式为________________________________。
(2)工艺流程中第一次加入硝酸调pH=7.0的目的是__________________________________________________________。
pH=7.0时,溶液中c(Al3+)=________(通常条件下,Ksp[Al(OH)3]=1.3×10-33)。
(3)若忽略杂质跟酸、碱的反应,则在碱溶、调pH=7.0、酸溶过程中,理论上消耗碱、酸的物质的量之比n1(NaOH)∶n2(HNO3)∶n3(HNO3)=________。
(4)现用1 t铝灰制硝酸铝晶体[Al(NO3)3·9H2O],最后生产出7.5 t硝酸铝晶体,若生产过程中铝元素的损失率为10%,计算铝灰中铝元素的质量分数。
4、选择题 氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的
[? ]
A. 酸性
B. 碱性
C. 两性
D. 氧化性
5、选择题 某混合溶液中含有MgCl2的浓度为2 mol·L-1,含AlCl3的浓度为3 mol·L-1,将此溶液200 mL中Mg2+转化为Mg(OH)2沉淀分离出来,至少需要1.6 mol·L-1的NaOH溶液的体积是(?)
A.3.2 L
B.2 L
C.1.5 L
D.1.8 L
|