1、选择题 在d轨道中电子排布成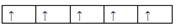 ,而不排成
,而不排成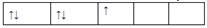 最直接的根据是? (? )
最直接的根据是? (? )
A.能量最低原理
B.泡利不相容原理
C.洪特规则的特例
D.洪特规则
参考答案:D
本题解析:洪特规则是在同一亚层中的电子尽可能分占不同轨道,而且自旋方向相同。
本题难度:一般
2、选择题 下列元素的电负性最大的是
A.Na
B.O
C.S
D.C
参考答案:B
本题解析:非金属性越强,电负性越大。在所给的元素中,氧元素的非金属性最强,则电负性最大的是氧元素,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点,主要是考查学生对元素电负性以及影响电负性强弱的了解掌握情况,旨在巩固学生的基础,提高学生的能力。
本题难度:简单
3、选择题 A元素的最高正化合价和负化合价的绝对值之差6,B元素与A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是
A.MgCl2
B.CaF2
C.SiO2
D.CS2
参考答案:A
本题解析:A元素的最高正化合价和负化合价的绝对值之差6,所以A是第ⅦA元素。A与B可形成化合物BA2,说明B是第ⅡA元素。又因为B元素与A元素的原子次外层上的电子数均为8,所以答案选A。
本题难度:一般
4、选择题 依据元素周期律及元素周期表知识,下列推断正确的是? ( )
A.酸性:H2SiO3>H2CO3
B.热稳定性:H2Se>H2S>H2O
C.碱性:CsOH>Ca(OH)2
D.若离子半径:R2->M+,则原子序数:R>M
参考答案:C
本题解析:碳、硅同主族,碳的非金属性比硅强,故酸性H2CO3>H2SiO3,A项错误;非金属性O>S>Se,故氢化物的稳定性H2O>H2S>H2Se,B项错误;若离子半径:R2->M+,则M位于R的下一周期,原子序数:M>R,D项错误。
本题难度:一般
5、选择题 盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是
①金属单质?②碱性氧化物?③碱?④非金属单质 ⑤酸性氧化物?⑥酸
A.①②③
B.①④⑥
C.②⑤⑥
D.全部
参考答案:D
本题解析:分析:根据金属单质与酸或某些盐溶液反应生成盐;碱性氧化物能与酸反应生成盐;酸与碱反应能生成盐和水;某些非金属单质与碱反应生成盐;酸性氧化物与碱反应生成盐来解答.
解答:①金属单质与酸或某些盐溶液反应可直接生成盐,如铁与盐酸反应生成盐为氯化亚铁,故①能;
②碱性氧化物能与酸反应可直接生成盐,如氧化钠与盐酸反应可直接生成氯化钠,故②能;
③碱与酸、酸性氧化物、某些盐等可反应生成盐,如氢氧化钠与二氧化碳反应可直接生成碳酸钠,故③能;
④非金属单质能与碱反应生成盐,如氯气与氢氧化钠反应生成氯化钠、次氯酸钠,故④能;
⑤酸性氧化物能与碱反应生成盐,如二氧化碳与氢氧化钾反应生成碳酸钾,故⑤能;
⑥酸能与碱、某些盐、碱性氧化物等反应生成盐,如盐酸与氢氧化钠反应生成氯化钠,故⑥能;
显然全部都能在一定条件下直接生成盐,故选D.
点评:本题考查常见物质的性质,明确不同类物质之间的相互转化及发生的化学反应是解答本题的关键,学生应熟悉不同类别物质的性质来解答.
本题难度:困难