1、推断题 (10分)A、B、C、D、E都是短周期元素,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是?乙物质的电子式是__________
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是_________ (用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是?
(4)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,其中有一种产物是TiC(在火箭和导弹上有重要应用)其反应方程式为?
参考答案:(1)第三周期第IIA族?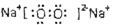 ?
?
(2)O<N<Al<Mg<Na
(3)2 Al + 2OH— + 2H2O = 2AlO2— + 3H2↑
(4)4Al + 3C +3TiO2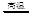 2Al2O3 +3TiC
2Al2O3 +3TiC
本题解析:根据“E是地壳中含量最高的金属元素”确定E为Al;根据“A原子的最外层电子数比次外层电子层多3个”确定A为N;根据“C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。”确定B为O,C为Na,最后根据“A、B、C、D、E都是短周期元素,原子序数逐渐增大”确定D为Mg;据此便可回答相关问题。
本题难度:一般
2、填空题 (每空2分?共8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1) C、Si、N元素的电负性由大到小的顺序是__________________。
(2) A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式_______________。
电离能/kJ·mol-1
| I1
| I2
| I3
| I4
|
A
| 932
| 1 821
| 15 390
| 21 771
|
B
| 738
| 1 451
| 7 733
| 10 540
|
(3) 过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布时,无颜色,d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+________颜色(填“无”或“有”)。
(4) 利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。COCl2分子的结构式为 Cl—eq o(sup 10(O║—Cl,则COCl2分子内含有________。
A.4个σ键? B.2个σ键、2个π键
C.2个σ键、1个π键? D.3个σ键、1个π键
参考答案:(每空2分,共8分)? (1) N>C>Si? (2) 1s22s22p63s2?(3) 有? (4) D
本题解析:(1)非金属性越强,电负性越大。C、Si、N元素元素的非金属性强弱顺序是N、C、Si,所以其电负性由大到小的顺序是 N>C>Si。
(2)根据电离能数据可知,两种元素的第三电离能远大于第二电离能,所以都是第ⅡA元素。由于金属性越强,第一电离能越小,所以A是Be,B是Mg。因此根据构造原理可知,镁原子的电子排布式1s22s22p63s2。
(3)[Mn(H2O)6]2+离子中锰的化合价是+2价,由于锰的原子序数是25,所以根据构造原理可知,3d轨道含有5个电子,所以该离子是有颜色的。
(4)单键都是由1个σ键构成的,而双键是由1个σ键和1个π 键构成的,因此根据光气的结构式可知,分子中含有3个个σ键和1个π 键,答案选D。
本题难度:一般
3、选择题 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是(?)
A.18O、31 P、119 Sn? B.27 Al、19 F、12 C
C.6C、16S、9F? D.1 H、13 C、35 Cl
参考答案:D
本题解析:A、18O的质子数和中子数均为偶数,不能产生,错误;B、12 C的质子数和中子数均为偶数,不能产生,错误;C、未指明质量数,无法确定,错误;D、1H、13C、35Cl中质子数或中子数为奇数,一定能产生NMR现象,正确,答案选D。
本题难度:简单
4、计算题 (7分)(1)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类分别为m、n。如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为____________;当B在A的下一周期时,B的原子序数为____________。如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______________;当B在A的下一周 期时,B的原子序数
期时,B的原子序数 为_____________。
为_____________。
(2) A、B两元素同周期,A位于ⅡA族,B位于ⅢA族,A的原子序数为x,B的原子序数为y,则y-x=_________或_________或_________。
参考答案:(1)x-n? x+m? x-m? x+n(2)y-x=1或11或25。
本题解析:略
本题难度:简单
5、选择题 下列各组中互为同位素的是?(?)
A.甲烷和乙烷
B.O2和O3
C.正丁烷和异丁烷
D. H和
H和 H
H
参考答案:D
本题解析:同位素的研究对象是原子,甲烷乙烷属于化合物,O2和O3属于单质,正丁烷和异丁烷属于化合物, H和
H和 H属于原子,答案选D。
H属于原子,答案选D。
点评:具有相同质子数不同中子数的一类原子的互称叫同位素。
本题难度:一般