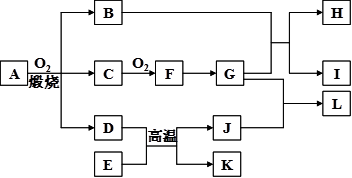
1、填空题 (12分)物质A-L之间的转化关系如图,部分反应物和生成物及反应条件已省略。化合物A是由三种元素组成的一种矿石的主要成分。A在氧气中高温煅烧生成B、C、D。B为砖红色固体,D、I均为红色固体,E、I、K是三种常见金属,其中组成E的元素是地壳中含量最高的金属元素。L可作净水剂,向L溶液中加入BaCl2溶液,会生成不溶于稀硝酸的白色沉淀,H溶液呈蓝色。
请回答下列问题:
(1)写出E和G的化学式:E?、G?。
(2)L可用作净水剂的原因是?(用离子方程式表示)。
(3)写出B和G反应的化学方程式?。
(4)D+E→K+J的反应中放出大量的热,这类反应被称为?反应,举出这类反应的一个应用实例:?。
(5)A的相对分子质量为184,A与O2反应得到B、C、D三种物质的物质的量之比为1︰4︰1 ,某种检验葡萄糖的反应中含有B生成,则A的化学式为?。
,某种检验葡萄糖的反应中含有B生成,则A的化学式为?。
(6)过量的I与含n molG的浓G溶液共热生成m molC,若给反应后的溶液中加入足量的K的粉末,则溶解掉K的质量为?g(用含n和m的代数式表示)。
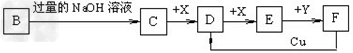
2、推断题 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去)
请回答下列问题: ?
(1)B的化学式为_____________;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3和HClO,则C与过量Cl2反应的化学方程式为___________,反应中的还原剂为___________;
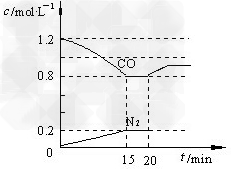
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g)?+?2CO(g)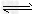 N2(g)?+?2CO2(g);△H<0。若在一定温度下,将1.4?mol?D、1.2?mol?CO充入1?L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g)?+?2CO2(g);△H<0。若在一定温度下,将1.4?mol?D、1.2?mol?CO充入1?L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为?K?=?____________; ?
②若保持温度不变,20?min?时再向容器中充入CO、N2各0.8?mol,平衡将________移动(填“向左”、?“向右”或“不”) ?
③20?min时,若改变反应条件,导致CO?浓度发生如图所示的变化,则改变的条件可能是__________(填序号); ?
a.缩小容器体积 ?b.增加CO2?的量 ? ?c.升高温度 ?d.加入催化剂
3、推断题 硫在空气中燃烧生成A,A溶于水得B,B和I2反应得C和D,C和Na2S反应得含硫化合物E,据此回答下列问题:
(1)写出各物质的分子式A________,B________,C________,D_______, E________。
(2)E和A、B、C中某种物质反应的方程式为:____________________
4、填空题 (12分)根据要求回答相关问题:
(1) 除去下列物质中所混有的少量杂质(括号内为杂质),写出有关的反应方程式。
①铜粉 (铝粉) ?;
②FeCl3溶液(FeCl2 )?;
③N2 (O2)? ____________________________________________________。
(2)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:?
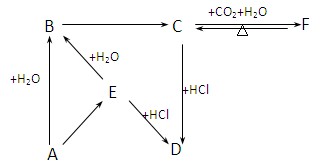 ?
?
①写出A→B的化学方程式,标出电子转移的方向和数目;
____________________________________________________________
②在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是?,主要原因是?;还可能是?,主要原因是?。
5、填空题 (6分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,A为日常生活中常见的金属单质, G为黄绿色气体,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。

请回答下列问题:
(1)H的化学式为_______________。(2)反应②在工业上通常称之为__________工业。
(3)写出反应③的离子方程式?。
(4)写出反应②的化学方程式?。