1、选择题 X、Y均为短周期元素,X位于ⅠA族,X、Y能形成X2Y型化合物,下列说法中正确的是(?)
A.X与Y形成的化合物中原子个数比可能为1:1
B.X2Y不可能是共价化合物
C.X和Y分别形成的简单离子不可能具有相同的电子层结构
D.根据周期表递变规律判断,X原子半径一定大于Y原子半径
参考答案:A
本题解析:根据题意,X可能是H、Li或Na,Y可能是O或S。X与Y可能形成原子个数比为1:1的化合物,如H2O2、Na2O2,A正确。X2Y可能是H2O、H2S等共价化合物,B错误。X和Y分别形成的简单离子可能具有相同的电子层结构,如Na+和O2-,C错误。如果X是H,则其原子半径在周期表所有的元素中最小,D错误。
本题难度:一般
2、选择题 下列说法中正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道图可表示为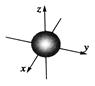
D.3d3表示3d能级有3个轨道
参考答案:C
本题解析:选项A不正确,核外电子的移动是没有规律的;选项B不正确,小黑点密度大,说明该处电子出现的机率就大;3d3表示3d能级含有3个电子,d能级含有5个轨道,选项D不正确,所以正确的答案选C。
本题难度:一般
3、推断题 (15分)铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。②CO常温下为气体,固态时属于?晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。 [Cu(NH3) n]+中Cu+与n个氮原子的空间结构呈?型,n=?。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
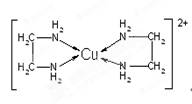
请回答下列问题:
①该配离子[Cu(En)2]2+中的中心原子的基态外围电子排布式为?。
②乙二胺分子中氮原子轨道的杂化类型为?,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是?。
③该配离子[Cu(En)2]2+中存在的作用力类型有?(填字母);
A配位键?B极性键?C离子键?
D非极性键?E.氢键?F.金属键
参考答案:(1)① <?② 分子?(2)直线形? 2
(3)①3d9?②sp3杂化?乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键?③ABD
本题解析:(1)①由于原子的比较C>O,元素的非金属性C<O。所以电负性:C<O。②CO常温下为气体,分子与分子之间通过分子间作用力结合形成分子晶体。因此在固态时属于分子晶体。(2)①在Cu+的4s轨道及4p通过sp杂化,是直线型的,所以[Cu(NH3) n]+中Cu+与n个氮原子的空间结构呈直线形,n=2。(3)①该配离子[Cu(En)2]2+中的中心原子Cu的基态外围电子排布式为3d9; ②乙二胺分子中氮原子轨道的杂化类型为sp3杂化;乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.增加了分子之间的相互作用,使物质气化消耗的分子间作用力大,需要的能量高,所以沸点高。③该配离子[Cu(En)2]2+中存在的作用力类型有A.N与Cu之间的配位键;B.N与H之间的极性键、C与H之间的极性键;D.C与C之间的非极性键。因此选项为A、B、D。
本题难度:一般
4、简答题 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
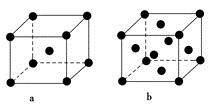
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体
| NaCl
| KCl
| CaO
|
晶格能/kJ·mol-1
| 786
| 715
| 3401
|
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
参考答案:(1)sp3 Na<Cl<F NaF(1分) HF和H2O分子之间能形成氢键
(2)1S22S22P63S23d104S1或〔Ar〕3d104S1(2分) 2∶1
(3)TiN>MgO>CaO>KCl
(4)CrO2
(5)6 2
本题解析:由题干信息可知,五种元素分别是:A-N B-Na C-F D-Cl E-Cu
(1)元素A简单氢化物是NH3,NH3中N采取sp3杂化,
(2)用切割法计算图a和b中的Cu原子
(3)晶格能越大熔点越高
(4)V2O5中V 没有未成对电子,CrO2中Cr含有2个未成对电 子
(5)CO2中有2个σ键和2个π键,4H2有4个σ键
本题难度:一般
5、判断题 (8分)现有下列短周期元素性质的数据:
编号
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径/10-10 m
| 0.66
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.70
| 0.88
|
最高化合价
和最低化合价
| -2
| +2
| +1
| +5
-3
| +7
-1
| +1
| +5
-3
| +3
|
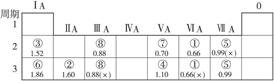
请确定以上8种元素在元素周期表中的位置,将元素的编号填入表中:
参考答案:

本题解析:由③⑥最高正价都为+1,知其都是ⅠA族元素;由其半径大小,可确定③位于⑥的上面;由于H原子半径最小,所以③不为H,因而位于第二周期。同理可确定⑦④的位置。最后可根据元素的主要化合价确定其他元素所在的主族,通过跟③⑥④⑦比较半径确定其所在的周期。
本题难度:简单