1、选择题 用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作情况会使测得的氢氧化钠溶液浓度偏低的是
A.酸式滴定管用水润洗后,直接注入标准浓度的盐酸
B.滴定过程中,滴定管有少量漏液
C.滴定前读数准确,滴定完毕俯视读数
D.锥形瓶用水润洗后,再用待测的氢氧化钠润洗
2、填空题 卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
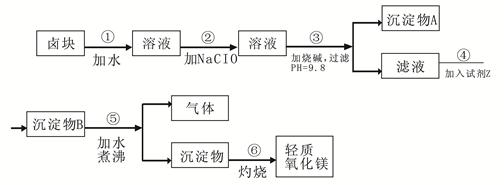
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:?
表1?生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(OH)2
| 9.6
| 11.1
|
?
表2?化学试剂价格表
试剂
| 价格(元/吨)
|
漂液(含NaClO,25.2%)
| 450
|
双氧水(含H2O2 ,30%)
| 2400
|
烧碱(含98% NaOH)
| 2100
|
纯碱(含99.5% Na2CO3)
| 600
|
?
(1)在步骤②中加入漂液而不是双氧水其原因是?。
写出加入NaClO发生反应的离子方程式?。
(2)在步骤③中控制pH=9.8,其目的是?。
(3)沉淀物A的成分为?,试剂Z应该是?。
(4)在步骤⑤中发生反应的化学方程式是?。
(5)若在实验室中完成步骤⑥,则沉淀物必需在?(填仪器名称)中灼烧。
3、选择题 下列除杂质(括号内为杂质)的实验设计不能达到预期目的是(?)
A.乙烷(乙烯):溴水,洗气
B.甲苯(苯酚):浓溴水,过滤
C.溴乙烷(乙醇):Na2CO3溶液,分液
D.乙醇(乙酸):碱石灰,蒸馏
4、实验题 (12分)已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
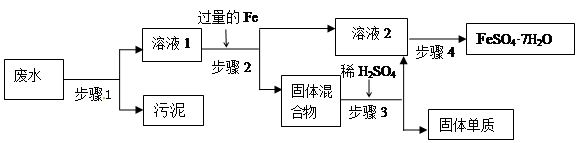
(1)步骤1、步骤2、步骤3的主要操作是?(填“相同”或“不相同”),需用到的玻璃仪器除烧杯外还有?。
(2)步骤2中发生反应的离子方程式为?
(3)步骤3中发生反应的化学方程式为?
(4)步骤4中涉及的操作是:蒸发浓缩.?.过滤.洗涤.烘干。
(5)最后的固体单质是________(填名称)
5、选择题 现有三组混合物:① 苯和水、② 汽油和柴油、③ 碘和氯化钠溶液,正确的分离方法依次是
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液