1、填空题 (12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
物质
| Cu(OH)2
| Fe(OH)3
| CuCl
| CuI
|
Ksp
| 2.2×10-20
| 2.6×10-39
| 1.7×10-7
| 1.3×10-12
|
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入?,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=?。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是??(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是?。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用?作滴定指示剂,滴定终点的现象是?。
②CuCl2溶液与KI反应的离子方程式为?。
③该试样中CuCl2·2H2O的质量百分数为?。
参考答案:(12分)(1) CuO或Cu(OH)2或 CuCO3或Cu2(OH)2CO3(1分)2.6×10-9 mol·L-1(2分)
(2)2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
(3) ①淀粉溶液(1分) 蓝色褪去,放置一定时间后不复色(1分)
②2Cu2++4I-===2CuI↓+I2 (2分)?③95%(2分)
本题解析:(1)由于在除杂的过程中不能引入新的杂质,所以要调节溶液的酸碱性,使氢氧化铁析出,而得到纯净的氯化铜晶体,则应该加入氧化铜或氢氧化铜。根据氢氧化铁的溶度积常数可知,当溶液的pH=4时,溶液中铁离子的浓度应该是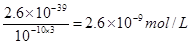 。
。
(2)由于氯化铜在溶液中存在铜离子的水解平衡,而加热促进水解,且生成的氯化氢极易挥发,进一步促进水解,因此得不到氯化铜晶体,反应的化学方程式使是2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。
Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。
(3)①由于碘离子被氧化生成了单质碘,而碘遇淀粉显蓝色,所以选择的指示剂是淀粉溶液。Na2S2O3将单质碘还原生成了碘离子,所以终点时的反应现象是蓝色褪去,放置一定时间后不复色。
②氯化铜能把碘化钾氧化生成单质碘,所以CuCl2溶液与KI反应的离子方程式是2Cu2++4I-===2CuI↓+I2。
③根据有关的反应方程式可知2CuCl2·2H2O~I2~2Na2S2O3,所以氯化铜晶体的物质的量是0.02L×0.1000mol/L=0.002mol,则试样中CuCl2·2H2O的质量百分数为 。
。
点评:本题是高考中的常见题型,属于难度较大的试题,考查的知识点比较多。这类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。本题有利于培养学生的逻辑推理能力,以及分析问题、解决问题的能力。
本题难度:一般
2、选择题 下列各组物质仅用水就能鉴别的是(?)
①NO2和溴蒸气 ②硝基苯和苯 ③固体NaOH和NaCl ④浓硫酸和稀硫酸 ⑤Na2SO4粉末和CuSO4粉末
A.①②④
B.②③⑤
C.①③④
D.①②③④⑤
参考答案:D
本题解析:NO2溶于水得无色HNO3溶液和气体NO,Br2溶于水得棕色的溴水,可区别。苯密度比水小,与水混合后现象为液体分层,上层是油层,下层是水层;硝基苯密度比水大,现象相反。NaOH溶于水放热,NaCl溶于水温度变化不明显,可用水区别。浓硫酸滴入水中温度升高明显,稀硫酸滴入水中,温度没有明显变化。Na2SO4粉末上滴加少量水无现象,CuSO4粉末滴加少量水,粉末变为蓝色。
本题难度:简单
3、简答题 实验来源于生活且服务于生活,请回答些列问题:
(1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是______
(2)由图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是______(注:不考虑导管被堵塞)
A.CO2(NaHCO3溶液)/无色喷泉B.NH3(H2O含酚酞)/红色喷泉C.H2S(CuSO4溶液)/黑色喷泉D.HCl(AgNO3溶液)/白色喷泉
(3)设计学生实验要注意安全、无污染、现象明显.根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散).下列气体的制取宜使用该装置的是______
A.用二氧化锰(粉末)与浓盐酸制氯气
B.用锌粒与稀硫酸制氢气
C.用碳酸钠固体与盐酸制二氧化碳
D.用碳酸钙(块状)与稀硫酸制二氧化碳
(4)为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是______
| 物质 | 试剂 | 分离方法
①
硝酸钾(氯化钠)
蒸馏水
重结晶
②
二氧化碳(氯化氢)
饱和碳酸钠溶液
洗气
③
乙醇(水)
生石灰
蒸馏
④
SiO2(Al2O3)
NaOH溶液
过滤
|
A.①②B.①③C.只有③D.③④

参考答案:(1)A、浓硫酸溶于水放热,具有腐蚀性,稀释浓硫酸时应将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,故A正确;
B、二氧化碳通入苯酚钠溶液中有苯酚生成,溶液变浑浊,可用来证明碳酸的酸性比苯酚强,故B正确;
C、氯化氢易溶于水中,产生喷泉,故C正确;
D、洗气瓶中的气体应长进短出,否则会将液体排出,故D错误.
故答案为:D;
(2)A、二氧化碳不溶于饱和碳酸氢钠溶液,不能形成喷泉,故A错误;
B、氨气易溶于水,溶液呈碱性,易形成喷泉,故B正确;
C、硫化氢与硫酸铜反应,生成黑色的硫化铜,反应后烧瓶内压强减小,能形成喷泉,故C正确;
D、氯化氢与硝酸银反应生成白色氯化银沉淀,反应后烧瓶内压强减小,能形成喷泉,故D正确.
故答案为:A;?
(3)A、浓盐酸与二氧化锰需在加热条件下反应,而本实验没有加热,故A错误;
B、锌粒不溶于水,与硫酸反应生成氢气,符合实验操作要求,故B正确;
C、碳酸钠溶于水,不符合实验要求,不能控制反应,故C错误;
D、碳酸钙与硫酸反应生成微溶的硫酸钙,使反应难以顺利进行,不符合实验要求,故D错误.
故答案为:B;?
(4)二氧化碳与饱和碳酸钠溶液反应,二氧化硅和氧化铝都能与强碱反应,不能用来分离物质,正确的为①③,氯化钠和硝酸钾的溶解度不同,可利用重结晶法分离,生石灰与水反应 生成难挥发的氢氧化钙,蒸馏可得到纯净的乙醇,
故答案为:B
本题解析:
本题难度:一般
4、实验题 已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂;烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1 NaOH、6 mol·L-1 NaOH、0.1 mol·L-1 HCl、蒸馏水。
必要时可参考:
沉淀物
| 开始沉淀时的pH
| 沉淀完全时的pH
|
Mg(OH)2
| 9.6
| 11.1
|
Fe(OH)3
| 2.7
| 3.7
|
?
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
实验操作
| 预期现象和结论
|
步骤1:
| ?
|
步骤2:
| ?
|
步骤3:
| ?
|
……
| ?
|
?
参考答案:
实验操作
预期现象和结论
步骤1:取少量浸取液于试管A中,逐滴滴加0.1 mol·L-1 NaOH溶液,充分振荡,边滴加边用pH试纸检测溶液直至pH在4~9,静置
有红褐色沉淀产生,说明浸取液中含Fe3+
步骤2:用滴管将试管A中上层清液转移至试管B,向试管B中滴加过量6 mol·L-1 NaOH溶液,充分振荡,静置
有白色沉淀产生,说明浸取液中含Mg2+
步骤3:另取少量浸取液于试管C中,滴加过量6 mol·L-1 NaOH溶液,充分振荡,静置
有沉淀产生
步骤4:用滴管将试管C中上层清液转移至试管D,向试管D中逐滴滴加0.1 mol·L-1 HCl至足量,边滴边振荡
有白色沉淀产生然后沉淀又溶解,说明浸取液中含Al3+
本题解析:本题属于离子检验的实验设计,难度中等。要检验Fe3+、Mg2+、Al3+主要是通过其在不同pH条件下存在的不同形式去考虑。由于Fe3+、Mg2+开始沉淀的pH分别为2.7、9.6,可以考虑先检验Fe3+,当pH不超过9.6时,会看到红褐色沉淀生成,如果在滤液中继续滴加NaOH至过量时,会出现白色沉淀可证明Mg2+的存在,对于Al3+的检验,主要是考虑其在碱性条件下先转化成AlO,再加酸(如盐酸)会出现先沉淀后溶解的现象。
本题难度:一般
5、选择题 用下图所示装置检验乙烯时不需要除杂的是(? )
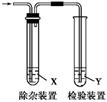
?
| 乙烯的制备
| 试剂X
| 试剂Y
|
A
| CH3CH2Br与NaOH乙醇溶液共热
| H2O
| KMnO4酸性溶液
|
B
| CH3CH2Br与NaOH乙醇溶液共热
| H2O
| Br2的CCl4溶液
|
C
| C2H5OH与浓H2SO4加热至170 ℃
| NaOH溶液
| KMnO4酸性溶液
|
D
| C2H5OH与浓H2SO4加热至170 ℃
| NaOH溶液
| Br2的CCl4溶液
|
?
参考答案:B
本题解析:A、CH3CH2Br与NaOH乙醇溶液共热制备的乙烯中含有乙醇,乙烯和乙醇都能使KMnO4酸性溶液褪色,所以用KMnO4酸性溶液检验乙烯必须除去其中的乙醇,错误;B、CH3CH2Br与NaOH乙醇溶液共热制备的乙烯中含有乙醇,乙醇不与Br2的CCl4溶液反应,所以用Br2的CCl4溶液检验乙烯不需要除乙醇,正确;C、C2H5OH与浓H2SO4加热至170 ℃制得的乙烯中可能含有二氧化硫气体和乙醇,二氧化硫、乙醇能与KMnO4酸性溶液反应而褪色,所以用KMnO4酸性溶液检验乙烯必须除去其中的二氧化硫和乙醇,错误; D.C2H5OH与浓H2SO4加热至170 ℃制得的乙烯中可能含有二氧化硫气体和乙醇,所以必须除去其中的杂质,错误。
本题难度:一般