1、选择题 用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作情况会使测得的氢氧化钠溶液浓度偏低的是
A.酸式滴定管用水润洗后,直接注入标准浓度的盐酸
B.滴定过程中,滴定管有少量漏液
C.滴定前读数准确,滴定完毕俯视读数
D.锥形瓶用水润洗后,再用待测的氢氧化钠润洗
参考答案:C
本题解析:A相当于稀释了盐酸,所以消耗盐酸的体积偏大,测定结果偏高。B中由于漏液,是的消耗的盐酸体积偏大,测定结果偏高。滴定管的读数自上而下逐渐递增,所以俯视读数,读数偏小,则盐酸的体积偏小,测定结果偏低。锥形瓶用水润洗后,再用待测的氢氧化钠润洗,则消耗盐酸的体积就偏大,,测定结果偏高。所以答案选C。
本题难度:简单
2、填空题 卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
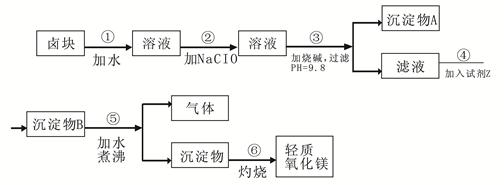
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:?
表1?生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(OH)2
| 9.6
| 11.1
|
?
表2?化学试剂价格表
试剂
| 价格(元/吨)
|
漂液(含NaClO,25.2%)
| 450
|
双氧水(含H2O2 ,30%)
| 2400
|
烧碱(含98% NaOH)
| 2100
|
纯碱(含99.5% Na2CO3)
| 600
|
?
(1)在步骤②中加入漂液而不是双氧水其原因是?。
写出加入NaClO发生反应的离子方程式?。
(2)在步骤③中控制pH=9.8,其目的是?。
(3)沉淀物A的成分为?,试剂Z应该是?。
(4)在步骤⑤中发生反应的化学方程式是?。
(5)若在实验室中完成步骤⑥,则沉淀物必需在?(填仪器名称)中灼烧。
参考答案:(1)漂液比H2O2的价格低得多。(2分)?2Fe2++ClO-+2H+=2Fe3++Cl-+H2O(3分)
(2)使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。(2分)
(3)Fe(OH)3 、 Mn(OH)2、 Mg(OH)2?(2分,写3个且全对得2分,只写其中2个且写对得1分,其他情况都得0分)?纯碱?(2分)
(4)MgCO3 +H 2O?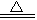 ?Mg(OH)2↓+ CO2↑?(3分,产物写成碱式碳酸镁也算正确)
?Mg(OH)2↓+ CO2↑?(3分,产物写成碱式碳酸镁也算正确)
(5)坩埚?(2分)
本题解析:(1)表2为一个试剂价格表,在漂白液和双氧水均可做氧化剂时,从经济角度应该选漂液更加实惠;因此加入漂白液次氯酸钠后发生的化学反应的离子方程式为
2Fe2+ ?+?ClO-+?2H+?= ?2Fe3+ ?+?Cl-+?H2O。
(2)从表1的离子沉淀PH值可以看出步骤③调节pH值目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。
(3)步骤③调节pH值使除Mg2+以外的各种杂质金属离子都沉淀了,但pH值已略微超过了Mg2+ 开始沉淀的pH值,所以得到的沉淀物A为Fe(OH)3 、 Mn(OH)2,也有 Mg(OH)2 ;沉淀物B在水中加热煮沸可以生成气体,同时又生成沉淀物Mg(OH)2 ,则沉淀物B一定不是Mg(OH)2 ,所以加入的Z物质在表2中只能选纯碱。
(4)加入的Z物质为纯碱,所以生成的沉淀物B是MgCO3,所以沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2 和CO2气体。化学方程式为MgCO3 +H 2O? ?Mg(OH)2↓+ CO2↑ 。
?Mg(OH)2↓+ CO2↑ 。
(5)氢氧化镁灼烧制备氧化镁,应该在耐高温的容器坩埚中进行。
本题难度:困难
3、选择题 下列除杂质(括号内为杂质)的实验设计不能达到预期目的是(?)
A.乙烷(乙烯):溴水,洗气
B.甲苯(苯酚):浓溴水,过滤
C.溴乙烷(乙醇):Na2CO3溶液,分液
D.乙醇(乙酸):碱石灰,蒸馏
参考答案:B
本题解析:乙烷中混有乙烯当通入溴水中的时候,乙烷不与溴水反应,而乙烯会与溴水反应生成液态的1,2—二溴乙烷,这样乙烯就会被出去,出来的只有乙烷和水蒸气,在进行洗气即可得到干燥的乙烷,A可以达到除杂目的,溴易溶于有机溶剂,当向甲苯中加入溴水会发生萃取,溴溶于甲苯中,形成溴的苯溶液,虽然溴与苯酚反应生成沉淀,除去了苯酚但是又引入了新的杂质溴,所以B不能达到目的。溴乙烷难溶于水,但乙醇易溶于水,当加入碳酸钠溶液后会发生分层,下层为溴乙烷然后进行分液即可分离出溴乙烷,C可以实现除杂目的;乙醇与碱石灰不反应,而乙酸会与碱石灰反应生成高沸点的乙酸钠溶液,又乙醇沸点较低,可以通过蒸馏的方法分离出乙醇,所以D可以实现分离目的,答案选B。
本题难度:简单
4、实验题 (12分)已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
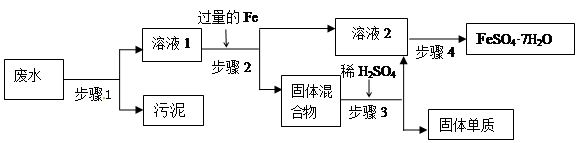
(1)步骤1、步骤2、步骤3的主要操作是?(填“相同”或“不相同”),需用到的玻璃仪器除烧杯外还有?。
(2)步骤2中发生反应的离子方程式为?
(3)步骤3中发生反应的化学方程式为?
(4)步骤4中涉及的操作是:蒸发浓缩.?.过滤.洗涤.烘干。
(5)最后的固体单质是________(填名称)
参考答案:(1)相同(2分)、普通漏斗(填漏斗0分)(1分), 玻璃棒(1分)错填0分
(2)Fe2+ + Cu==Cu2+ + 2Fe(2分)
(3)Fe+ H2SO4 ="=" FeSO4 + H2 ↑?(2分无气体符号扣1分)
(4)冷却结晶(或填结晶给1分)(2分)?(5)铜(2分填化学式0分)
本题解析:(1)步骤1的目的是除去污泥的,步骤2的目的是除去铁和铜,步骤3的目的是除去铜,所以操作是相同的,都是过滤。过滤需用到的玻璃仪器除烧杯外还有普通漏斗、玻璃棒。
(2)铁的金属性强于铜,所以铁能置换出铜,方程式为Fe2+ + Cu==Cu2+ + 2Fe。
(3)过量的铁能和稀硫酸反应,但铜和稀硫酸不反应,所以方程式为Fe+ H2SO4 ="=" FeSO4 + H2 ↑。
(4)要从溶液中得到硫酸亚铁晶体,应该通过蒸发浓缩、冷却结晶来实现。
(5)铜和稀硫酸不反应,所以最后得到的是铜。
本题难度:一般
5、选择题 现有三组混合物:① 苯和水、② 汽油和柴油、③ 碘和氯化钠溶液,正确的分离方法依次是
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
参考答案:C
本题解析:① 苯和水互不相溶,分上下两层,可用分液的方法分离;② 汽油和柴油,是由沸点不同的烃组成,用蒸馏的方法可将它们分离;③ 碘和氯化钠溶液,碘在有机溶剂中的溶解度比较大,可用萃取的方法将它从水溶液中分离出来;纵上所述,C正确,选C。
考点?:物质的提纯和分离
本题难度:一般