1、填空题 (10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A的原子核无中子,能与B、C分别形成10电子的化合物;B、C 的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
(1)C与D形成的化合物的电子式?.
(2)写出D的单质与CO2反应的化学方程式?.
(3)“嫦娥 一号”发射所用的液体燃料是上述?(填元素名称)元素的单质.
一号”发射所用的液体燃料是上述?(填元素名称)元素的单质.
(4)工业上,使元素E的低价氧化物转化为其最高价氧化物的设备名称为?.
(5)在一定的条件下,A2、B2混合物经过一段时间的反应后,B2的浓度减小了0. 3 mol/L.[此时间内A2表示的化学反应速率为0. 45 mol/(L·s).则此段反应时间为?s
参考答案:(1)(略)? (2) 2Mg + CO2=C+ 2MgO? (3)氢? (4)接触室? (5)? 2
本题解析:略
本题难度:一般
2、简答题 物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.
(1)若X、W是常见的非金属单质,该反应在工业上可用来生产水煤气.
①该反应的化学方程式是______.
②WXYZ中常用作冶炼金属的还原剂的有______(填序号)种.
a.1b.2c.3d.4
(2)若X、W是常见的金属单质.Y是红棕色固体,常用作红色油漆和涂料.
①该反应的化学方程式是______.
②将一定量的X溶于足量的NaOH溶液,产生的气体在标况下的体积为336mL.若等质量的X与足量的Y发生反应,则生成W的物质的量为______mol.
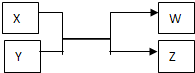
参考答案:(1)该反应在工业上可用来生产水煤气,应为C和H2O的反应,则X为C,Y为H2O,W为H2,Z为CO,
①生产水煤气的反应方程式为C+H2O高温. CO+H2,故答案为:C+H2O高温.CO+H2;
②C、CO和H2常用于冶炼金属的还原剂,共3种,故答案为:c;
(2)Y是红棕色固体,常用作红色油漆和涂料,应为Fe2O3,则X与Y的反应应为铝热反应,X为Al,W为Fe,Z为Al2O3,
①该反应为铝热反应,反应的方程式为Fe2O3+2Al高温.2Fe+Al2O3,故答案为:Fe2O3+2Al高温.2Fe+Al2O3;
②n(H2)=0.336L22.4L/mol=0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.
本题解析:
本题难度:一般
3、选择题 根据 ,下列说法不正确是
,下列说法不正确是
①X一定是单质;
②反应Ⅱ一定是化合反应;
③若强酸为HNO3,氧化物一定是酸性氧化物;
④若强碱为NaOH,氧化物一定是Na2O。
A.①③
B.②③
C.②③④
D.全部
参考答案:D
本题解析:①X可以是单质,也可以是化合物,如NO与O2反应转化为NO2,NO2与H2O反应生成HNO3,错误;②如NO2与H2O反应生成HNO3和NO,Na2O2与H2O反应生成NaOH和O2,都不是化合反应,错误;③NO2与H2O反应可生成HNO3,NO2不是酸性氧化物,错误;④Na2O2与H2O反应也能生成NaOH,错误。
本题难度:一般
4、选择题 已知:(1)A、C均能与稀H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷浓H2SO4中发生钝化反应,由此可以推断A、B、C、D、E依次为( )
A.Fe、Cu、Al、Ag、Mg
B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe
D.Mg、Ag、Al、Cu、Fe
参考答案:C
本题解析:
本题难度:简单
5、填空题 现有X、Y、Z三种元素,已知X元素的单质和燃烧时和氧气反应生成X2O2,在空气中X2O2可吸收二氧化碳生成碳酸盐并放出氧气,其碳酸盐分子内各原子的质子数总和为52;Y单质0.45g与盐酸完全反应,可生成YCl3和标准状况的氢气560mL.Y元素的核内有14个中子;元素Z的气态氢化物为H2Z,其+4价的氧化物在标准状况下的密度为2.875g-L-1,Z元素原子核内质子数和中子数相等.
(1)请写出X、Y、Z的元素符号及元素名称:X______,Y______,Z______.
(2)写出X2O2吸收二氧化碳的化学方程式______.
(3)写出Y单质与盐酸反应的离子方程式______.
参考答案:现有X、Y、Z三种元素,已知X元素的单质燃烧时和氧气反应生成X2O2,在空气中X2O2可吸收二氧化碳生成碳酸盐并放出氧气,其碳酸盐分子内各原子的质子数总和为52,则X为钠元素;Y单质0.45g与盐酸完全反应,可生成YCl3和标准状况的氢气560mL,Y为金属,令Y的摩尔质量为Mg/mol,则0.45gMg/mol×3=0.56L22.4L/mol×2,解得M=27.Y元素的核内有14个中子,所以Y的质子数为27-14=13,故Y为铝元素;元素Z的气态氢化物为H2Z,其+4价的氧化物为ZO2,在标准状况下的密度为2.875g?L-1,ZO2相对分子质量为2.875×22.4=64,所以Z元素的相对原子质量为32,Z元素原子核内质子数和中子数相等,则Z元素质子数为16,故Z为硫元素.
故X为钠元素;Y为铝元素;Z为硫元素.
(1)由上述分析可知,X为钠元素,元素符号为Na;Y为铝元素,元素符号为Al;Z为硫元素,元素符号为S.
故答案为:钠、Na;铝、Al;硫、S.
(2)X2O2为Na2O2,过氧化钠与二氧化碳反应生成碳酸钠和氧气,Na2O2吸收二氧化碳的化学方程式为
2Na2O2+2CO2=2Na2CO3+O2↑.
故答案为:2Na2O2+2CO2=2Na2CO3+O2↑.
(3)Al单质与盐酸反应生成氯化铝和氢气,反应的离子方程式为2Al+6H+=2Al3++3H2↑.
故答案为:2Al+6H+=2Al3++3H2↑.
本题解析:
本题难度:一般