| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《难溶电解质的溶解平衡》高频试题巩固(2017年最新版)(十)
参考答案:B 本题解析:A、同浓度的CaCl2和NaCl溶液中氯离子浓度前者是后者的2倍,故AgCl在同浓度的CaCl2和NaCl溶液中的溶解度前者小于后者,错误;B、pH=4.5的番茄汁中c(H+)=10—4.5,pH=6.5的牛奶中c(H+)=10—6.5,前者是后者的100倍,正确;C 、某溶液中由水电离出来的c(H+)和c(OH—)的乘积为1×10—24,该溶液可能呈强酸性,也可能呈强碱性,酸性条件下H+和[Al(OH)4]—反应生成氢氧化铝沉淀或铝离子和水,不能大量共存,错误;D、常温下0.1 mol·L—1 HA溶液的pH>1,则HA为弱酸,0.1 mol·L—1 BOH溶液中c(H+)/c(OH—)=10—12,则BOH为强碱,将这两种溶液等体积混合,混合后溶液为BA强碱弱酸盐溶液,离子浓度的大小关系为:c(B+)>c(A—)>c(OH—)>c(H+),错误。 本题难度:困难 2、选择题 (1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。 |
参考答案:C
本题解析:A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,错误;B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,错误;C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=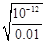 =10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)=
=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=2×10?10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)=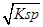 =
=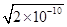
=1.41×10-5,而S(Ag2CrO4)= =3/2
=3/2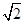 ×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误。
×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误。
考点:本题考查沉淀溶解平衡。
本题难度:一般
3、选择题 已知25℃时,AgCl的溶度积K sp =1.8×10 -10,则下列说法正确的是
[? ]
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10mol2.L-2,在任何含AgCl 固体的溶液中,c(Ag+) =c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2.L-2
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知25 。C时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为 1.25×10-5 mol/L。若在5 mL含有KCl和KI各为0.01 mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
[? ]
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
参考答案:A
本题解析:
本题难度:一般
5、填空题 氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题: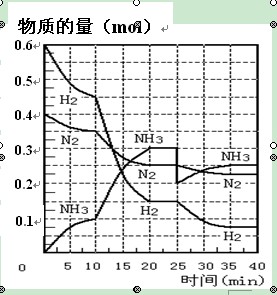
(1)10 min内以NH3表示的平均反应速率?;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ?;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为:?平衡常数K1 ="_____________" ?(表达式),第2次平衡时NH3的体积分数 ?;
(4)在反应进行至25 min时, 曲线发生变化的原因:??
参考答案:(12分,每空2分)(1) v = 0.005 mol·L-1 ·min-1?(没有单位不给分)
(2)? AB?(漏选得1分,错选不给分)
(3):? 20~25 min?K1 = 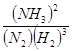 ?45.5 %
?45.5 %
(4)?移走0.1 mol NH3(没有指出0.1mol的给1分)
本题解析:(1)根据图像可知,10min时氨气的物质的量是0.1mol,所以氨气的反应速率是 。
。
(2)根据图像可知,在10 ~20 min内NH3浓度增加,氮气和氢气的浓度减小,这说明反应向正反应方向进行。因为该反应是体积减小的、放热的可逆反应,所以改变的条件可能是缩小容器体积或降低温度,答案选BC。
(3)根据图像可知,在20 ~25 min内各种物质的浓度不再发生变化,即反应达到平衡状态,所以第1次平衡的时间范围为20 ~25 min。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数K1=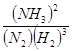 ;同样根据图像可知,反应进行到35min时,各种物质的浓度不再发生变化,即反应达到平衡状态。此时氢气、氮气和氨气的物质的量分别是0.075mol、0.225mol、0.25mol,所以第2次平衡时NH3的体积分数是
;同样根据图像可知,反应进行到35min时,各种物质的浓度不再发生变化,即反应达到平衡状态。此时氢气、氮气和氨气的物质的量分别是0.075mol、0.225mol、0.25mol,所以第2次平衡时NH3的体积分数是 。
。
(4)根据图像可知,在25 min时,氨气的物质的量由0.3mol降低到0.2mol,所以改变的条件是移走了0.1molNH3。
点评:该题是中等难度的试题,也是高考中的常见题型。试题综合性强,侧重对学生能力的培养。试题在注重基础知识巩固,侧重对学生解题方法的指导与训练。有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《无机综合与.. | |