1、选择题 下列说法或表示方法正确的是?
A.在稀溶液中,H+(aq)+ OH—(aq)= H2O(l)△H =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石)△H =" +1.90" kJ/mol可知金刚石比石墨稳定
C.相同温度下,①pH=5的NH4Cl溶液、② pH=4的稀盐酸中由水电离出的c (H+):①<②
D.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+) > c(CH3COO—)
参考答案:A
本题解析:A选项浓硫酸溶于水会放热,故反应放出的热大于57.3 kJ。B选项金刚石比石墨稳定是由它们的结构决定的。C选项NH4Cl在水溶液中会发生水解促进水的电离,而在稀盐酸溶液中,氢离子浓度大,会抑制水的电离,故由水电离出来的c (H+):①>②。D选项由电荷守恒可得:c(Na+)+ c (H+)= c(CH3COO—)+c(OH—),溶液的PH=5.6,c(OH—)<c (H+),故c(Na+) <c(CH3COO—)。
点评:本题A、B选项涉及到了中和热的定义和物质能量的比较,物质能量越高,越不稳定,后两个选项涉及弱电解质的电离中,离子浓度的比较,注意使用电荷守恒,物料守恒来比较。
本题难度:一般
2、选择题 下列关于反应能量变化的相关常识论断错误的是?
A.吸热反应不一定都要加热才反应
B.化学键的断裂和形成是化学反应中能量变化的根源
C.选择燃料只需考虑燃料热值大小
D.若反应物的总键能大于生成物的总键能则反应为吸热反应
参考答案:C
本题解析:反应是放热反应还是吸热反应,与反应条件无关系,A正确。如果断键吸收的能量大于形成化学键所放出的能量,则该反应就是吸热反应,反之是放热反应,选项BD正确。C不正确,选择燃料不能仅考虑燃料热值大小,而应该是综合考虑,答案选C。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练。该题的关键是明确反应热的含义以及影响因素,并能结合题意灵活运用即可。有利于培养学生的逻辑推理能力,也有助于培养学生的环境保护意识和能源节约意识。
本题难度:简单
3、选择题 关于下图,下列说法不正确的是
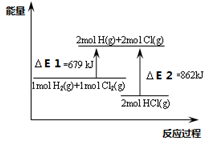
A.△E1是该反应的活化能
B.△E2是破坏2mol HCl(g)所需的能量
C.该反应的热化学方程式为H2+Cl2=2 HCl△H=-183KJ/mol
D.该反应是一个反应物总能量高于生成物总能量的反应
参考答案:C
本题解析:热化学方程式需标注反应物生成物状态;
C.该反应的热化学方程式为H2(g)+Cl2(g)=2 HCl (g)?△H=-183KJ/mol。
本题难度:简单
4、选择题 人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等。如果从能量变化的角度来认识,下面说法中正确的是
[? ]
A.化学变化都是放热的
B.反应物所含能量等于生成物所含能量
C.化学变化都是吸热的
D.化学反应前后反应物和生成物所含能量会发生变化
参考答案:D
本题解析:
本题难度:简单
5、选择题 今有如下三个热化学方程式:
H2(g)+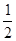 O 2(g)==H2O(g)?ΔH="a" kJ·mol-1;
O 2(g)==H2O(g)?ΔH="a" kJ·mol-1;
H2(g)+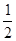 O 2(g)==H2O(l)?ΔH="b" kJ·mol-1;
O 2(g)==H2O(l)?ΔH="b" kJ·mol-1;
2H2(g)+O2(g)====2H2 O(l)?ΔH="c" kJ·mol-1。
关于它们的下列表述正确的是
A.a<b
B.a、b、c均为正值
C.a=b
D.2b=c
参考答案:D
本题解析:氢气的燃烧反应为放热反应,反应热的值为“—”;即B错;由于气态水转化为液态水要放出热量,所以可得a>b,即A错;C错;H2(g)+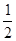 O 2(g)==H2O(l)? ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l)? ΔH="c" kJ·mol-1的物质的量相差2倍关系,即可得2b=c;
O 2(g)==H2O(l)? ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l)? ΔH="c" kJ·mol-1的物质的量相差2倍关系,即可得2b=c;
本题难度:简单