1、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数(25 ℃)
| K1=1.77×10-4
| K1=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
|
下列选项错误的是
A.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
B.相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者
C.2CN-+H2O+CO2 = 2HCN+CO32-
D.2HCOOH+CO32-= 2HCOO-+H2O+CO2↑
参考答案:C
本题解析:A. HCOOH和HCN都是弱酸,由于HCOOH的电离平衡常数大于HCN,所以等体积、等pH的HCOOH和HCN溶液中溶质的物质的量n(HCN)>n(HCOOH),所以反应消耗的NaOH的量n(HCN) >n(HCOOH),正确;B.由于酸性HCOOH>HCN,根据盐的水解规律:谁弱显谁性,越弱越水解,所以相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者,正确;C.由于HCN 的电离平衡常数小于H2CO3的一极电离平衡常数,大于碳酸的二级电离平衡常数,所以发生反应:CN-+H2O+CO2 = HCN+HCO3-,错误;D.由于甲酸的电离平衡常数大于碳酸的一极电离平衡常数,所以发生反应:2HCOOH+CO32-= 2HCOO-+H2O+CO2↑,正确。
考点:考查弱酸的电离平衡常数在反应的进行、酸碱中和、盐的水解中的应用的知识。
本题难度:一般
2、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
B.等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
C.pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
参考答案:D
本题解析:A、混合后的溶液呈中性,则有c(OH-)= c(H+),同时溶液满足电荷守恒,则有c(Cl-)+c(OH-)+c(CH3COO-)= c(H+)+ c(Na+),所以有c(Cl-)+ c(CH3COO-)= c(Na+),根据物料守恒可得c(CH3COOH)+ c(CH3COO-)= c(Na+),所以c(Cl-)= c(CH3COOH),错误;B、等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合,二者的物质的量相等,所以C(K+)= C(SO42-),则离子浓度的大小关系是C(Na+)> C(K+)= C(SO42-)> C(HS-)> C(OH-)>C(H+),错误;C、二元弱酸的酸式盐NaHA溶液的pH<7,根据电荷守恒和物料守恒得c(H+)+ c(Na+)="2" c(A2-)+c(OH-) +c(HA-),c(Na+)= c(A2-)+c(H2A) +c(HA-),二者结合消去c(Na+),可得c(H+)+ c(H2A)= c(A2-)+c(OH-),错误;D、醋酸是弱酸,溶液越稀越易电离,所以pH=3与pH=2的醋酸溶液中前者溶液的浓度与后者的溶液浓度之比小于1:10,所以中和等物质的量的氢氧化钠时消耗的氢离子的物质的量相等,则消耗醋酸溶液的体积前者体积与后者体积之比大于10:1,Va>10Vb,正确,答案选D。
考点:考查溶液混合的判断
本题难度:一般
3、填空题 已知在0.1mol?L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).
(1)该溶液中c(H+)______c(OH-)(填“>”“=”或“<”),简述理由(用离子方程式表示):______.
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是______;写出该反应的离子方程式:______.
参考答案:(1)由于NaHSO3溶液中,c(SO32-)>c(H2SO3),说明亚硫酸氢钠的电离程度大于水解程度,反应的离子方程式为:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3;
故答案为:>;HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,且电离程度大于水解程度;
(2)逐滴加入少量含有酚酞的NaOH溶液,发生了反应,HSO3-+OH-═SO32-+H2O,氢氧化钠溶液的红色会褪去;
故答案为:红色褪去; HSO3-+OH-═SO32-+H2O.
本题解析:
本题难度:简单
4、填空题 写出下列盐溶液的水解离子方程式:
(1)Fe(NO3)3 ;
(2)NaF ;
(3)K2CO3 ; ;
参考答案:(1)Fe3+ +3H2O 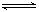 Fe(OH)3 + 3H +
Fe(OH)3 + 3H +
(2)F- +H2O 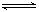 HF + OH-
HF + OH-
(3)CO32-+H2O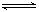 HCO3-+ OH- ;
HCO3-+ OH- ;
HCO3-+H2O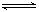 H2CO3+ OH-
H2CO3+ OH-
本题解析:(1)多元弱碱阳离子一步水解
(3)多元弱酸的酸根离子要分多步水解
本题难度:一般
5、填空题 (10分)氯化铁水解的离子方程式为  ______ ______ ___ ,
______ ______ ___ ,
配制氯化铁溶液时滴加少量盐酸的作用是 ___ ;
若向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐逐渐溶解,并产生无色气体,其离子方程式为 ,
同时有红褐色沉淀生成的原因是 、
把FeCl3溶液蒸干后再灼烧,最后得到的主要固体产物是
参考答案:

本题解析:略
本题难度:一般