| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》考点巩固(2017年最新版)(六)
参考答案:D 本题解析:根据质子守恒有:c(OH-)=c(HC 本题难度:一般 2、选择题 0.1mol/L醋酸钠 |
参考答案:B
本题解析:略
本题难度:一般
3、选择题 用NA表示阿伏伽德罗常数的值,下列说法不正确的是
A.常温下,1mol CO2含有的氧原子数为2NA
B.0.1mol/L的Al2(SO4)3溶液中含SO42-数为0.3NA
C.标况下9g水所含分子数为0.5NA
D.常温下,2g氦气所含有原子数为0.5NA
参考答案:B
本题解析:0.1mol/L的Al2(SO4)3溶液缺少体积,故物质的量不确定,从而无法确定粒子数目,B错误,答案选B.
考点:阿伏伽德罗常数
本题难度:一般
4、选择题 为了除去MgCl2酸性溶性中的Fe3+可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是
A.NH3
B.NaOH
C.Na2CO3
D.MgCO3
参考答案:D
本题解析:Fe3+易水解生成沉淀,可通过调节溶液pH的方法促进Fe3+的水解,达到除杂的目的,A.加入氨水混入氯化铵杂质,且生成氢氧化镁沉淀,错误;B.加入NaOH易生成氢氧化镁沉淀,且混入NaCl杂质,错误;C.加入碳酸钠,易混入NaCl杂质,错误;D.加入碳酸镁,与氢离子反应,可起到调节溶液pH的作用,促进铁离子的水解生成氢氧化铁沉淀而除去,且不引入新的杂质,正确,选D。
考点:考查盐类水解的应用。
本题难度:一般
5、填空题 (12分)常温下,ZnS的溶度积常数Ksp=1.20×10-23 ,H2S的电离常数K1=1.32×10-7 K2=7.10×10-15 回答下列问题:
(1)K1>>K2的原因是
(2)0.1 mol/L H2S溶液中氢离子的物质的量浓度是 (填字母)
A.等于0.1mol/L
B.等于0.2mol/L
C.小于0.1mol/L
D.在0.1~0.2mol/L之间
(3)0.1mol/LNa2S 溶液能使pH试纸变蓝,表明该现象的离子方程式是
(4)已知0.1mol/LNaHS溶液的pH约为9,则0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是 。该溶液中的质子守恒关系式为
。
(5)向0.01mol/L的ZnCl2溶液中通入H2S(g)至饱和(c(H2S)按0.1mol/L计),为保证不产生ZnS沉淀,应控制c(H+)不低于 mol/L(已知7.811/2 =2.8)
参考答案:(1)H2S第一步电离出的H+,对HS-的电离起到抑制作用,使HS-更难电离出H+ (2)C (3)S2- +H2O HS-+ OH-
(2)C (3)S2- +H2O HS-+ OH-
(4)c(Na+) > c(HS-) >c(OH-) > c(H+)> c(S2-); c(H2S)+c(H+) =c(OH-)+c(S2-)
(5)0.28
本题解析:(1)根据电离方程式H2S HS-+H+、HS-
HS-+H+、HS- S2-+H+可知,H2S第一步电离出的H+,对HS-的电离起到抑制作用,使HS-更难电离出H+,所以K1远大于K2。
S2-+H+可知,H2S第一步电离出的H+,对HS-的电离起到抑制作用,使HS-更难电离出H+,所以K1远大于K2。
(2)根据H2S的电离平衡常数可知,溶液中氢离子浓度是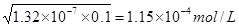 ,所以答案选C。
,所以答案选C。
(3)硫化钠是强碱弱酸盐,S2-水解显碱性。水解方程式为S2- +H2O HS-+ OH-。
HS-+ OH-。
(4)已知0.1mol/LNaHS溶液的pH约为9,说明HS-的水解程度大于HS-的电离程度,所以溶液中各离子浓度由大到小的顺序是c(Na+) > c(HS-) >c(OH-) > c(H+)> c(S2-)。根据电荷守恒c(H+) +c(Na+) ==c(HS-)+c(OH-)+2c(S2-)和物流守恒c(Na+) ==c(HS-)+c(OH-)+c(H2S)可知,质子守恒是c(H2S)+c(H+)=c(OH-)+c(S2-)。
(5)溶液中锌离子浓度是0.01mol/L,所以根据溶度积常数表达式可知,硫离子浓度是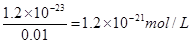 。根据电离平衡常数表达式可知
。根据电离平衡常数表达式可知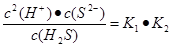 ,所以此时溶液中氢离子浓度是
,所以此时溶液中氢离子浓度是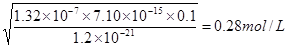 ,即溶液中氢离子不能低于0.28mol/L。
,即溶液中氢离子不能低于0.28mol/L。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《离子共存》.. | |