|
|
|
高考化学知识点总结《盐类水解的原理》考点巩固(2017年最新版)(七)
2018-03-17 06:50:50
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题:
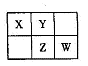
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3)AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是 。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式 。
2、选择题 物质的量浓度相同的下列溶液中,NH4+ 浓度最大的是( )
A.NH4Cl
B.NH4HSO4
C.CH3COONH4
D.NH3·H2O
|
3、填空题 为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L
C.c(H+)<c(OH-)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
|
4、选择题 下列溶液中,因水解反应而呈碱性的是
A.KOH
B.FeCl3
C.CuSO4
D.Na2CO3
5、选择题 下列表示水解反应的离子方程式中,正确的是( ? )
A.CO32-+2H2O?H2CO3+2OH-
B.Fe3++3H2O?Fe(OH)3↓+3H+
C.CH3COO-+H2O?CH3COOH+OH-
D.NH3+H2O?NH3?H2O