1、选择题 复合材料的优点是
[? ]
①强度高 ②质量轻 ③耐高温 ④耐腐蚀
A、仅①④
B、仅②③
C、除③外
D、①②③④
参考答案:D
本题解析:
本题难度:简单
2、填空题 (12分)I:能源是人类生活和社会发展的基础,地球上最基本的能源是? ▲?,大自然利用这一能源最成功的是? ▲?。氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水。)请写出氢气燃烧的热化学方程式? ▲?。
Ⅱ:理论上任意一个自发的氧化还原反应都能设计成原电池,现有如下反应:
2FeCl3 + Cu = 2FeCl2 + CuCl2
如果将其设计成原电池,请写出负极材料及正极电极反应式。
负极材料:? ▲?;正极电极反应式:? ▲?。
III:工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出工业用电解熔融氧化铝制取铝的化学方程式:? ▲?。
(2)现冶炼2.7 t 铝,需要转移电子的物质的量为? ▲?mol。
参考答案:(4分) ②、①、④、③(每空1分)
本题解析:略
本题难度:一般
3、填空题 分子筛具有均匀的微孔结构,分子筛筛分作用见下图。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

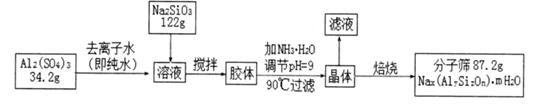
在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%。
(1)分子筛的孔道直径为4A(1 A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用?型分子筛。
(2)A12(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为?
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为?;检验其中金属阳离子的操作方法是?
(4)加NH3·H2O调节pH后,加热到90℃并趁热过滤的原因可能是?
(5)该生产流程中所得分子筛的化学式为?
参考答案:(12分)
(1)5A(1分)
(2) 2A13++3SiO32-+ 6H2O=2Al(OH)3+3H2SiO3? (2分)
(3)Na+、NH4+、SO42-(2分)?将铂丝(或铁丝)放在酒精灯外焰上灼烧至无色时,蘸取待测溶液再放在酒精灯外焰上灼烧,若火焰呈黄色,说明待测液中含有Na+(2分)
(4)加热能促进胶体凝聚,趁热过滤可防止其它杂质结晶析出?(2分)
(5)Na(AlSi3O12)·3H2O或 ( Na2O·Al2O3·10SiO2·6H2O)(3分,其它合理答案均给分)
本题解析:该工艺是利用铝离子和硅酸根离子发生双水解反应,得到胶体,然后通过焙烧后得到分子筛。
(1)根据直径大小,4.65A和5.6A,故使用5A分子筛可以分离;
(2)该反应为双水解反应
(3)根据加入物质为Al2(SO4)3、Na2SiO3、NH3·H2O,故Al、Si、Na转化到晶体中,故滤液中有Na+、NH4+、SO42-。检验Na+用焰色反应,检验NH4+用NaOH,再检验NH3;
(5)根据原子利用率及守恒关系可以确定分子式。
本题难度:困难
4、填空题 (14分)草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是?。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。

①则A-B发生反应的化学方程式为:?。
②精确研究表明,B?-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式:??、
?;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为:?。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极?、负极?。
参考答案:(每空2分共14分)
(1)抑制Fe2+水解
(2)①FeC2O4·2H2O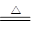 FeC2O4+2H2O
FeC2O4+2H2O
②FeC2O4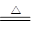 FeCO3+CO↑? FeCO3=FeO+CO2↑
FeCO3+CO↑? FeCO3=FeO+CO2↑
(3)Li2CO3+FeC2O4+SiO2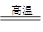 Li2FeSiO4+2CO2+2H2O
Li2FeSiO4+2CO2+2H2O
②LiFeSiO4+Li++e—==Li2FeSiO4 ?Li—e—=Li+
本题解析:(1)由于Fe2+易水解生成浑浊,故需要加入相应的酸抑制其水解
(2)在氩气环境中,二价铁不会被氧化;
①结晶水非常加热易失去,再结合图示数据可知AB段确为失去结晶水的过程:FeC2O4·2H2O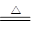 FeC2O4+2H2O
FeC2O4+2H2O
②结合FeC2O4所含有元素及加热所生成的气体只能为CO或CO2,由二者的分子量的大小可知,第一步分解过程中生成的为CO,而第二点分解得到的气体为CO2;
C点所得物质的分子量为:180×40%=72,恰好为FeO的式量;同时由于第二步有CO2的生成,可知第一步分解所得固体物质含碳及氧元素,则可判定为FeCO3
故两步反应分别为:FeC2O4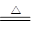 FeCO3+CO↑? FeCO3=FeO+CO2↑
FeCO3+CO↑? FeCO3=FeO+CO2↑
(3)①由元素的守恒、结合反应物及产物的组成、反应条件可综合判定,合成硅酸亚铁锂的化学方程式为:Li2CO3+FeC2O4+SiO2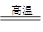 Li2FeSiO4+2CO2+2H2O
Li2FeSiO4+2CO2+2H2O
②由总反应可知,金属锂失电子,化合价生成,做负极:Li—e—=Li+;
由总反应减去负极反应可得正极反应式为:LiFeSiO4+Li++e—==Li2FeSiO4
本题难度:一般
5、选择题 下列器具不属于陶瓷制品的是( )
A.唐三彩
B.砂锅
C.蒸发皿
D.表面皿
参考答案:D
本题解析:
本题难度:一般