1、选择题 我国十分重视海水资源的综合利用,下列物质不需经化学变化就能从海水中获得的是(?)
A.氯 、溴、碘
、溴、碘
B.钠、镁、铝
C.烧碱、氢气
D.食盐、淡水
2、选择题 想一想,下面三个词为什么归纳在一起?然后从所给的四个词中选出一个与它们同类.陶瓷、玻璃、水泥( )
A.光导纤维
B.有机玻璃
C.人造纤维
D.砖瓦
3、填 空题 (5分)海洋面积占地球总面积的71% 。海洋中含有丰富的资源,海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
(1)写出镁元素在周期表中的位置:?
(2)氯化钠的电子式?,用电子式表示水的形成过程?
(3)写出重水中的氢元素的核素符号:?
4、选择题 下列叙述正确的是
A.金属被人类开发利用的大致年限之所以有先后,主要取决于金属在地壳中的含量多少
B.海水中含有丰富的碘元素,因此碘被称为“海洋元素”
C.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁
D.在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法
5、实验题 (12分)氯化铁是常见的水处 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
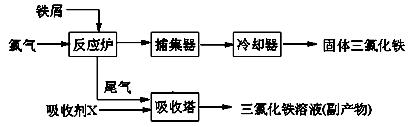
(1)试写出吸收塔中反应的离子方程式:?。
(2)已知六水合氯化铁在水中的溶解度如下:
温度/℃
| 0
| 10
| 20
| 30
| 50
| 80
| 100
|
溶解度(g/100gH20)
| 74.4
| 81.9
| 91.8
| 106.8
| 315.1
| 525.8
| 535.7
|
?从FeCl3溶液中获得FeCl3·6H2O的方法是:?。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ?mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250mL容量瓶,用蒸馏水定容;取出25mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL。
(已知:2Fe3+ +2I-= I2+2Fe2+?I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:?。
②滴定至终点,实验数据如下表所示:
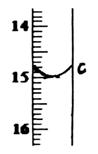
(第一次滴定终点的数据如右图中c点所示,请将你读得的数据填入表中)
滴定次数
| 待测液体积(mL)
| 滴定前读数(mL)
| 滴定后读数(mL)
|
第一次
| 25.00
| 0.00
| c=?
|
第二次
| 25.00
| 0.00
| 14.99
|
第三次
| 25.00
| 0.00
| 15.01
|
则样品中氯化铁的质量分数为?(写出最终的计算结果)。
③下列操作可能使测定结果偏低的是?。
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数