1、选择题 废电池伴着生活垃圾将是人类环境的新公害。下列哪种组合中的元素均是废电池中所含的有害元素(?)
A.Hg、Pb、C、Na?
B.Cu、K、S、P
C.Hg、Pb、Mn、Ni?
D.Br、N、Pb、As
参考答案:C
本题解析:可以用排除法得到正确答案,A中的Na元素不是有害元素;B中的K元素不是有害元素;D中的N元素不是有害元素。
本题难度:简单
2、填空题 钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:?
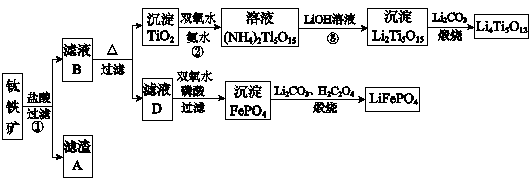
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是?。
(2)滤渣A的成分是?。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是?。
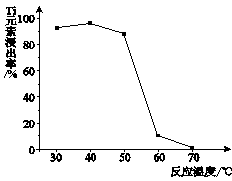
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是?。
(5)反应③的化学方程式是?。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是?。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是?。
参考答案:(12分,每空2分)
(1)+2
(2)SiO2
(3)TiOCl42-+H2O  TiO2↓+2H++4Cl-
TiO2↓+2H++4Cl-
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5) (NH4)2Ti5O15+2LiOH=Li2Ti5O15↓+2NH3·H2O(或2NH3+2H2O)
(6)20/9(1分)
(7)LiFePO4 – e-=FePO4+Li+(1分)
本题解析:(1)根据题目所给信息:可表示为FeO·TiO2,可知Fe的化合价为:+2。
(2)FeTiO3、MgO、CaO与HCl反应,剩下的固体只有SiO2。
(3)过滤后未加其他反应物,所以TiOCl42-与H2O反应,生成TiO2,同时生成H+、Cl?。
(4)TiOCl42- 转化为TiO2时,需要加入反应物双氧水、氨水,这两种物质受热易分解。
(5)(NH4)2Ti5O15为铵盐,LiOH为强碱,发生复分解反应,根据反应规律,即可写出化学方程式。
(6)分析反应流程,H2O2把Fe2+氧化为Fe3+,H2C2O4把Fe3+还原为Fe2+,H2O2中O由-1价变为-2价,H2C2O4由+3价变为+4价,根据电子转移总数相等得:m(H2O2)×17÷200g/mol×2=m(H2C2O4)÷90g/mol×2,得m(H2O2):m(H2C2O4)= 20/9。
(7)电池充电时阳极反应为失电子反应,LiFePO4中Fe失去1个电子,由+2价变为+3价,生成FePO4,同时得到Li+。
本题难度:困难
3、选择题 从海水中获得物质和能量具有广阔的前景,下列做法不正确的是
A.蒸馏法是海水淡化的方法之一
B.海洋植物如海带、海藻中含有丰富的碘元素,所以多食海带可治疗和预防甲状腺肿大
C.氯化钠、氯化镁和单质溴等物质不需要化学变化就能够从海水中获得
D.重视和开发潮汐能、波浪能等新型清洁能源,有利于人类的可持续发展
参考答案:C
本题解析:略
本题难度:简单
4、填空题 电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:

用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:

已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用 ?①?。
(2)脱色槽中应加入的物质X是?②?;设备A的作用是?③ ;设备B的名称为 ?④?;设备C的作用是 ?⑤?。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是?⑥?。
A.水
B.浓硫酸
C.石灰乳
D.硝酸