1、计算题 (8分)某工厂用FeC13溶液腐蚀镀有铜的绝缘板生产印刷电路。
(1)用离子方程式表示其化学原理?。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00 mL。废液,向其中加入0.64 g金属铜,金属铜全部溶解;又取50.00 mL废液,向其中加入足量AgNO3溶液,析出沉淀43.05 g。请回答以下问题:
(2)该厂生产后废液中所含金属阳离子有
(3)该厂原来使用的FeCl3溶液的物质的量浓度为?。(设反应前后溶液的体积无变化);
(4)若向500.00 mL废液中加入足量的稀硝酸,在
标准状况下生成NO气体4.48 L,则原废液中各
金属阳离子的物质的量浓度之比为?。(离
子与比值一一对应)。
参考答案:

本题解析:略
本题难度:一般
2、简答题 如图所示,将图1、图2两个装有不同物质的针筒用导管连接起来,将图2针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同).
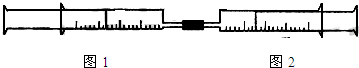
试回答下列问题:
| 实验序号 | 图1针筒内物质 | 图2针筒内物质 | 图1针筒的现象
1
10mLFeSO4溶液
10mLNH3
生成白色沉淀,后变色
2
10mL1mol/LAlCl3溶液
40mL1mol/LNaOH溶液
______
3
10mL紫色石蕊试液
25mLCl2
______
4
15mLCl2
40mLNH3
______
|
(1)实验1中,沉淀最终变为______色,写出沉淀变色的化学方程式______.
(2)实验2图1针筒内的现象是:______,写出有关反应的离子方程式:______、______.
(3)实验3图1针筒内的现象是:______,反应后图2针筒内有少量的残留气体,正确的处理方法是将其通入______溶液中.
(4)实验4中,已知:3Cl2+2NH3=N2+6HCl.图1针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为______.
参考答案:(1)NH3+H2O?NH3?H2O?NH4++OH-,FeSO4+2NH3?H2O═Fe(OH)2↓+(NH4)2SO4,Fe(OH)2为白色沉淀,在空气中易被空气中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O═4Fe(OH)3,Fe(OH)3为红褐色,
故答案为:红褐,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)10mL1mol/L的AlCl3溶液与40mL1mol/L的NaOH溶液反应,0.01molAlCl3与0.04molNaOH?反应,根据?
? Al3++3OH-=Al(OH)3↓? Al(OH)3 +OH?-=AlO2-+2H2O
?0.01mol? 0.03mol?0.01mol?0.01mol?0.01mol?0.01mol?
? 现象为:先有白色沉淀,后沉淀溶解.
故答案为:先有白色沉淀,后沉淀溶解、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;
(3)Cl2+H2O?HCl+HClO,HCl和HClO均具有酸性,能使紫色石蕊试液变红,HClO具有强氧化性,能漂白指示剂红色褪去.Cl2+2NaOH═NaCl+H2O+NaClO
多余氯气用NaOH吸收.
故答案为:先变红后褪色、NaOH;
(4)根据方程式可知:3Cl2+2NH3═N2+6HCl?
? 15mL? 10mL? 5mL? 30mL
生成30mLHCl,剩余的NH3为30mL,
由NH3+HCl═NH4Cl?
?30mL? 30mL?
可知,生成的HCl与剩余的NH3恰好完全反应生成NH4Cl,随着反应的进行,Cl2的量逐渐减少,最终完全反应.
所以最后剩余的气体为5mL无色的N2.
故答案为:黄绿色变为无色.
本题解析:
本题难度:一般
3、实验题 硫酸亚铁是一种可用于治疗缺铁性贫血的药剂。硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治疗贫血的药效)。试设计一个实验方案,验证某硫酸亚铁药片是否已被氧化。写出主要实验步骤、现象和有关反应离子的方程式。
(1)主要步骤:________________________________________________________。
(2)离子方程式:______________________________________________________。
参考答案:(1)刮去药片的糖衣,把药片研碎,放在烧杯中加少量蒸馏水溶解,滴几滴KSCN溶液,若溶液显红色,则硫酸亚铁已被氧化
(2)Fe3++SCN-══Fe(SCN)2+
本题解析:FeSO4被氧化后生成Fe2(SO4)3,验证药片是否已被氧化只需检验是否含Fe3+即可。检验Fe3+的存在一般用KSCN。
本题难度:简单
4、实验题 (12分)(1)磁铁矿的主要成分是Fe3O4,其组成也可以表示成FeO·Fe2O3。现提供以下试剂,从中选择合适的药品,证明磁铁矿石中存在+2价铁元素。
试剂:稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KSCN溶液、KMnO4溶液、氯水
步骤及现象:
取少量磁铁矿石样品,加入过量的_______溶解,取溶解后的液体少许,加入__________________,观察到________ __________________________________现象,可证明磁铁矿石中存在+2价铁元素。
__________________________________现象,可证明磁铁矿石中存在+2价铁元素。
(2)有Fe2+、NO-3、Fe3+、NO、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平)?。
②该反应中氧化剂与还原剂的物质的量之比为?。
③产生2mol还原产物时转移电子的总数为?。
参考答案:(1)稀硫酸;少量KMnO4溶液,振荡;紫色褪去
(2)①Fe2++H++NO3-→Fe3++NO↑+H 2O
2O
②1﹕3?
③6NA
本题解析:略
本题难度:一般
5、实验题 草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有?。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1:?;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
实验步骤
| 实验现象
| 实验结论
|
步骤1:向试管中加入少量固体产物,再加入足量?,充分振荡。
| 若溶液颜色明显改变,
且有红色固体生成。
| 有Fe存在。
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。
| ?
| ?
|
步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液,?
?。
| ?
?。
| 有FeO存在。
|
?
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为?(写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式?。
参考答案:(1)CO、CO2(共2分;答对1个给1分)
(2)【提出假设】Fe或铁(共1来源:91考试网 91EXAm.org分)
【实验方案】
实验步骤
实验现象
步骤1:CuSO4溶液(共1分)
?
步骤3:滴加适量氯水,充分振荡后滴加KSCN溶液(共2分;加“氯水”和“KSCN溶液”各给1分,顺序可以颠倒)
溶液呈红色(共1分;实验操作颠倒,注意对应现象不同)
?
【反思提升】FeO+CO Fe+CO2
Fe+CO2
(3)FeC2O4 FeO+CO↑+CO2↑ (共2分)
FeO+CO↑+CO2↑ (共2分)
本题解析:(1)澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成,说明草酸亚铁分解的气体产物中含有CO2、CO;则碳元素既由+3价升高到+4价,又由+3价降低到+2价,由此可知FeC2O4 FeO+CO↑+CO2↑;(2)由于CO具有强还原性,可能将FeO还原为Fe,即FeO+CO
FeO+CO↑+CO2↑;(2)由于CO具有强还原性,可能将FeO还原为Fe,即FeO+CO Fe+CO2,则猜想1为铁或Fe;(3)由限选的已知试剂和实验现象逆推,步骤1的反应为Fe+CuSO4=FeSO4+Cu;FeO+2HCl=FeCl2+H2O,FeCl2遇KSCN溶液不变红,但氯水能将其氧化为FeCl3,FeCl3遇KSCN变红;(3)略。
Fe+CO2,则猜想1为铁或Fe;(3)由限选的已知试剂和实验现象逆推,步骤1的反应为Fe+CuSO4=FeSO4+Cu;FeO+2HCl=FeCl2+H2O,FeCl2遇KSCN溶液不变红,但氯水能将其氧化为FeCl3,FeCl3遇KSCN变红;(3)略。
本题难度:一般