| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》试题巩固(2017年最新版)(六)
参考答案:A 本题解析:A、燃烧热是指1摩尔可燃物完全燃烧生成稳定的氧化物,所以当方程式系数为2时,表示是2摩尔一氧化碳反应,反应热为2×283.0kJ/mol,选A;B、硫酸和氢氧化钙生成硫酸钙沉淀,生成1摩尔水时反应热不是-57.3kJ/mol,不选B;C、需要加热的反应不一定是吸热反应,不选C;D、1摩尔甲烷完全燃烧生成稳定的氧化物时的反应热为燃烧热,即生成液态水,不是生成气态水,不选D。 本题难度:一般 2、选择题 下列物质中既有配位键,又有离子键,还有共价键的是( ) 参考答案:A 本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知选项A正确,B中只有极性键,C中有极性键和分子间作用力,D中有非极性键和分子间作用力。答案选A。 本题难度:一般 3、填空题 (12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。 |
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
参考答案:(1) H2(l)+O2(l)===H2O(g);ΔH=-237.46 kJ/mol (2分)
(2) ΔH=+16.3 kJ/mol (2分)
(3)①NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol (2分)
②A、C、E (2分) ③-51.8 kJ/mol (2分) ④不相等 相等 (2分)
本题解析:(1)考查盖斯定律的应用。根据①H2(g)+O2(g)=H2O(l)、②H2(g)=H2(l)、③O2(g)=O2(l)、④H2O(l)=H2O(g)可知,将①-②-③×1/2+④得到H2(l)+O2(l)===H2O(g),所以反应热是-285.8 kJ/mol+0.92 kJ/mol+3.42 kJ/mol+44.0 kJ/mol=-237.46 kJ/mol。
(2)②+③+④-①得到NH4Cl(s)===NH4Cl(aq),所以反应热是-35.1 kJ/mol -72.3 kJ/mol-52.3 kJ/mol+-176 kJ/mol=+16.3 kJ/mol。
(3)要计算放出的热量,就必须知道温度的变化量,以及溶液的质量。由于已经知道了密度和溶液的体积,所以不需要知道溶液的质量。利用体积和密度即可计算出质量。
(4)实验1、2、3中的温度差分别是23.2℃-20.05℃=3.15℃、23.4℃-20.3℃=3.1℃、23.6℃-20.55℃=3.05℃,其平均值是3.1℃,所以反应热是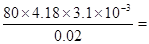 -51.8 kJ/mol。参加的反应的盐酸和氢氧化钠的体积发生了变化,所以放出的热量会变化,但中和热是不变的。
-51.8 kJ/mol。参加的反应的盐酸和氢氧化钠的体积发生了变化,所以放出的热量会变化,但中和热是不变的。
本题难度:一般
4、简答题 (15分)
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=-86.6kJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2:,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为 。
②下列选项能判断该反应达到平衡状态的依据的有____ 。
A.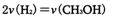
B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化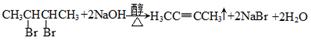 (3)已知在常温常压下:
(3)已知在常温常压下:
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为____
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 。
参考答案:(15分)
(1)极性(2分)
(2)60%(2分) CF(2分,全对得2分,只选1个且正确的得1分,选错1个扣1分,扣完为止)
(3)(b-a-4c)/2(3分)
(4)CH3OH-6e-+8OH-=CO32-+6H2O(3分) 3.2g(3分,数值正确、未写单位的扣1分)
本题解析: (1) 甲醇分子的正负电荷重心不重合,所以甲醇是极性分子;
(2)①:设消耗CO的物质的量为xmol,则CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
开始时(mol) 1 2 0
消耗(mol) x 2x x
平衡时(mol)1-x 2-2x x
根据题意可得1-x+2-2x+x=3/5(1+2)
解得x=0.6
所以CO的转化率为0.6mol/1mol×100%=60%
②A、未指明正逆反应且比例关系不符合化学计量数之比,错误;B、CO的消耗速率等于CH3OH的生成速率,均是正反应速率,未达平衡也符合,错误;C、恒容条件下,该反应的气体压强开始时一直减小,达平衡时不再变化,正确;D、恒容条件下,气体的总质量不变,所以气体的密度始终不变,错误;E、该反应中的气体均无色,错误;F、气体的总质量不变,物质的量在减小,混合气体的平均相对分子质量在减小,达平衡时,混合气体的平均相对分子质量不再变化,正确,答案选CF。
(3)根据盖斯定律,目标方程式=1/2(①-②)+2×③,所以△H=1/2(b-a)-2c=(b-a-4c)/2;
(4)①燃料电池的负极是燃料发生氧化反应,结合电解质溶液,所以负极的电极反应式为
CH3OH-6e-+8OH-=CO32-+6H2O
②溶液中各离子的物质的量分别为:n(Cu2+)=0.1mol,n(Cl-)=0.4mol,电解开始时,阳极是氯离子放电生成氯气2Cl---2e-=Cl2↑,阴极是Cu2++2e-==Cu,当0.1molCu2+放电完毕后H+放电2H++2e-==H2↑,此时阳极生成0.1mol氯气;随后阴极和阳极产生的氢气和氯气的物质的量相等,只有氯离子放电完毕后,才有可能两极产生的气体体积相等。当氯离子放电完毕,OH-开始放电时两极产生的气体的物质的量分别是阳极:Cl2 0.2mol,阴极:H2 0.1mol;设当生成O2xmol时两极产生的气体相等,则阴极又产生H22xmol,所以0.2+x=0.1+2x,解得x=0.1mol,所以氧气得质量为3.2g;
考点:考查分子极性的判断,化学平衡的计算,盖斯定律的应用, 电化学原理的应用
本题难度:困难
5、选择题 下列图示与对应的叙述不相符的是 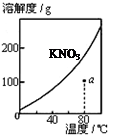
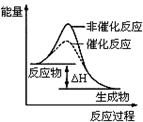


图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示反应aA(g)+bB(g)
 cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
参考答案:C
本题解析:C、反应应为放热反应,错误。
考点:考查物质的性质、反应热、图像等相关知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质的分离.. | |