1、填空题 现有下列电解质溶液:①Na2CO3 ②NaHCO3 ③ ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)__________。
(2)已知酸性H2CO3> >HCO3-。常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)__________>__________>__________。
>HCO3-。常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)__________>__________>__________。
?(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式________________________________。
?(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH__________7(填“>”、“=”或“<”),理由是__________________。
2、填空题 现有下列电解质溶液:① Na2CO3 ② NaHCO3 ③? ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3
已知酸性H2CO3 >?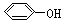 > HCO3-
> HCO3-
(1)常温下,物质的量浓度相同的① 、②、③溶液pH大小顺序为(填写序号):_____>_____>_____。
(2)写出⑤与足量NaOH溶液混合加热反应的离子方程式____________________。
(3)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH_____7(填>、=或<)
(4)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为_________。
(5)将标准状况下的4.48 L氨气完全溶解在含0.1 mol HCl的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是_______________。
(6)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性, AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表示为__________________________。
3、选择题 室温下,取0.3 mol/L HY溶液与0.3 mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
[? ]
A. 混合溶液中由水电离出的c(OH-)=10-9 mol/L
B. 溶液中离子浓度由大到小的顺序为c(Y-)>c(Na+)>c(OH-)>c(H+)
C. c(Na+)+c(H+)=c(OH-)+c(Y-)
D. c(Na+) =c(Y-)+c(HY) =0.3 mol/L
4、选择题 向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是
[? ]
A.Va>Vb时:c(CH3COOH) +c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)c(OH-)>c(H+)?
D.Va与Vb,任意比时:c(K+) +c(H+) =c(OH-)+c(CH3COO-)
5、选择题 25℃时,关于下列各溶液的叙述中,正确的是( )
A.25℃时,将20?mL?0.1mol?L-1H2SO4溶液和30mL?0.15mol?L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
B.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液?②pH=3的HCl溶液?③pH=11的氨水中由水电离出的c(H+):①>③>②
C.常温下,0.1?mol/L?HA(某酸)溶液pH≠l,则BA(盐)溶液pH一定大于7
D.25℃时,pH相同的溶液①CH3COONa?②C6H5ONa?③NaHCO3中c(Na+):①>③>②