1、选择题 下列有关溶液中相关量的关系描述一定正确的是
[? ]
A.物质的量浓度相等的氨水和NH4Cl溶液等体积混合(设溶液中无氨分子存在):
2c(H+)+ c(NH4+)=c(NH3·H2O)+2c(OH-)
B.pH=2的盐酸和pH=12的Ba(OH)2溶液混合后:pH=7
C.稀盐酸中逐滴加入氨水至pH>7:c(NH4+)> c(Cl-)> c(OH-)> c(H+)
D.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1=b
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.稀释Na2CO3溶液时,[c(HCO3-)·c(OH-)]/c(CO32-)增大
B.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)?的?△H<0,?△S<0 ?
C.用0.1mol/LCH3COOH溶液滴定0.1mol/L?NaOH至中性时:c(CH3COO-)+?c(CH3COOH)=c(Na+) ?
D.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
参考答案:B
本题解析:
本题难度:一般
3、选择题 常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.1L?0.l?mol?L-1(NH4)2Fe(SO4)2的溶液中c(NH
)+c(Fe2+)+c(H+)=c(OH-)+c(SO)
B.0.1?mol?L-1?NH4HS溶液中:c(NH)<c(HS-)+c(H2S)+c(S2-)
C.0.1?mol?L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO)=c(HCO)+3c(H2CO3)+2c(H+)
参考答案:A.该溶液中存在电荷守恒,即c(NH4+)+2c(Fe2+)+c(H+)=c(OH-)+2c(SO4 2-),故A错误;
B.根据物料守恒得c(NH4+)+c(NH3.H2O)=c(HS-)+c(H2S)+c(S2-),所以c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B正确;
C.0.1?mol?L-1 NaHA溶液pH为4说明HA-电离程度大于水解程度,所以c(A2-)>c(H2A),故C错误;
D.混合溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HCO3 -)+2 c(CO3 2-),存在物料守恒c(Na+)=32[c(HCO3 -)+c(CO3 2-)+c(H2CO3)],所以混合溶液中存在2c(OH-)+c(CO3 2-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确;
故选BD.
本题解析:
本题难度:一般
4、简答题 某溶液含有下表离子中的几种(不考虑水的电离及离子的水解).溶液中阴离子物质的量为0.2mol,阳离子物质的量为0.3mol,阳离子只有两种.
| 阳离子 | Ba2+?NH4+?Fe3+?Al3+?Fe2+
阴离子
OH-?CO32-?Cl-?SO32-?SO42-
|
①若向原溶液中加入过量稀盐酸,无气体生成,得到溶液A.
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,溶液中析出白色沉淀.过滤,得滤液B.
③往B中加入过量NaOH溶液并加热,有4.48L刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成.过滤,得滤液C,此过程中沉淀的量不减少.
④若向原溶液中加入稀HNO3,再加足量BaCl2,有46.6g白色沉淀生成.
根据上述实验回答下列问题.
(1)原溶液中一定不存在的阴离子是______.
(2)写出③总的离子方程式______.
(3)若原溶液由一种盐溶解于水制得,则该盐的化学式为______.
(4)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则这两种盐的化学式为______,其物质的量之比为______.
ⅰ、M溶液中各离子浓度由大到小的顺序为______.
ⅱ、实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,原因是______.
参考答案:(1)①若向原溶液中加入过量稀盐酸,无气体生成,得到溶液A,说明溶液中一定不含有CO32-、SO32-;
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,溶液中析出白色沉淀,过滤,得滤液B,因溶液A中含有Cl-,所以原溶液中不一定含有Cl-;
④若向原溶液中加入稀HNO3,再加足量BaCl2,有46.6g白色沉淀生成,所以原溶液中一定有SO42-,一定不含Ba2+,硫酸钡的物质的量为0.2mol,则SO42-的物质的量为0.2mol,因溶液中阴离子物质的量为0.2mol,所以溶液中阴离子只有SO42-,一定没有Cl-,
③往B中加入过量NaOH溶液并加热,有4.48L(0.2mol)刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成.过滤,得滤液C,此过程中沉淀的量不减少,说明溶液B中含有NH4+、
Fe3+或Fe2+、则原溶液中一定含有NH4+、Fe3+或Fe2+,一定没有OH-、Al3+,因阳离子只有两种,所以则原溶液中一定只有NH4+、Fe3+或Fe2+,因NH3的物质的量为0.2mol,根据NH4+、~NH3,得NH4+的物质的量也为0.2mol,又因阳离子物质的量为0.3mol,阳离子只有两种,所以Fe3+或Fe2+的物质的量为0.1mol,根据电荷守恒,离子为Fe2+,一定不含Fe3+,
综上所述,溶液中的阳离子:NH4+、Fe3+,阴离子有:SO42-,一定没有的离子是:Ba2+、Al3+、Fe3+、OH-、CO32-、Cl-、
SO32-,原溶液中一定不存在的阴离子是OH-、CO32-、Cl-、SO32-,故答案为:OH-、CO32-、Cl-、SO32-;
(2)B与过量NaOH溶液并加热,有4.48L刺激性气味气体产生,同时有红褐色沉淀生成,方程式为:2NH4++Fe3++5OH-?加热?.?2NH3↑+Fe(OH)3↓+2H2O,故答案为:2NH4++Fe3++5OH-?加热?.?2NH3↑+Fe(OH)3↓+2H2O;
(3)溶液含有0.2molNH4+,0.1molFe2+,0.2molFe2+,三者的个数之比为:2:1:2,
所以化学式为:(NH4)2Fe(SO4)2,故答案为:(NH4)2Fe(SO4)2;
(4)因两种盐溶解于水制得:(NH4)2Fe(SO4)2,所以这两种盐的化学式为:(NH4)2SO4和FeSO4,物质的量之比为:1:1,因FeSO4的相对分子质量大于和(NH4)2SO4,所以M溶液为(NH4)2SO4,因铵根离子水解,
所以离子浓度:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:(NH4)2SO4和FeSO4;?1:1;c(NH4+)>c(SO42-)>c(H+)>c(OH-);?
(5)为减少过滤时该盐的损失,因趁热过滤,故答案为:减少过滤时该盐的损失;
本题解析:
本题难度:一般
5、填空题 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g)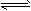 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高
SO2平衡转化率的有________(填字母)
(A)升高温度 (B)降低温度 (C)增大压强 (D)减小压强 (E)加入催化剂 (G)移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为_________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是_______________________。
参考答案:(1)解: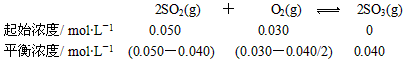
所以,K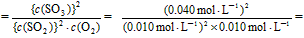 1.6×103 mol·L-1。
1.6×103 mol·L-1。
二氧化硫的转化率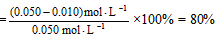 (2)BC
(2)BC
(3)SO2+H2O+Na2SO3=2NaHSO3
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
本题解析:
本题难度:一般