1、计算题 在50 mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)求稀释后的溶液中H+的物质的量浓度
(2)若a=9,求生成的气体中NO2的物质的量
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O。若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH溶液恰好被吸收,求需要NaOH溶液的体积。
参考答案:(1)1mol/L? (2)0.125 mol? (3) 150ml
本题解析:(1)6.4g?Cu的物质的量为6.4g÷64g/mol=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,溶液中c(NO3-)=c(H+)+2c(Cu2+),因此溶液中c(H+)=2c(Cu2+)-c(NO3-)=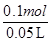 ×2-3mol/L=1mol/L。
×2-3mol/L=1mol/L。
(2)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-)=0.05L×9mol/L=0.45mol-0.1L×3mol/L=0.15mol,令NO2、NO的物质的量分别为xmol、ymol,则:x+y=0.15、x+3y=0.1×2,解得,x=0.125,y=0.025。
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为0.15mol÷1L/mol=0.15L=150mL。
本题难度:一般
2、填空题 配平下列化学方程式
(1)___Zn + ___HNO3 ------ ___Zn(NO3)2 + ___NH4NO3 +_________
(2)___I- + ___IO3- + ___H+ ------ ___I2 + ___H2O
(3)___P + ___CuSO4 + ___H2O ------- ___Cu3P + ___H3PO4 + ___H2SO4
参考答案:(1)4;10;4;1;3H2O
(2)5;1;6;3;3
(3)11;15;24;5;6;15
本题解析:
本题难度:一般
3、填空题 肼(N2H4)是火箭发射常用的燃料。
(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子?时,可制得Cu2O的质量为__________。
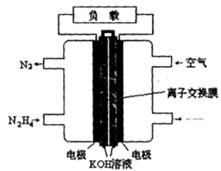
(2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
参考答案:(1)N2H4+4Cu(OH)2= 2Cu2O+N2+6H2O?14.4g
(2)①N2H4+4OH--4e-=N2+4H2O?② 右侧?左侧
本题解析:(1)根据题意可知该反应的方程式为:N2H4+4Cu(OH)2="==" 2Cu2O+N2+6H2O。每产生2摩尔的Cu2O,转移电子4NA。当反应中转移0.2 mol电子时,可制得Cu2O 0.1mol,其质量为0.1mol×144g/mol =14.4g.
(2)根据题意可知:在该肼(N2H4)为燃料的电池中,通入肼(N2H4)的电极为负极,通入空气的电极正极。负极的电极反应式为:N2H4+4OH--4e-="==" N2+4H2O,电池工作时电子由负极经过负载到正极,产生的电流则从右侧的电极经过负载后流向左侧的负极。2H4)的性质及在燃料的电池应用的知识。
本题难度:一般
4、填空题 (7分)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
____________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,方框内填数字,短线上填写物质的化学式或离子符号。
VO2+ + H2C2O4 + ______ → VO2+ + CO2 + ______
(3)当收集到标准状况下气体112毫升时,电子转移的数目为
(4)甲同学提出:上述反应能否用盐酸酸化?乙同学认为:要回答这个问题还得知道
A.VO2+ 和HCl氧化性相对强弱 B.VO2+ 和Cl2氧化性相对强弱 C.上述均不正确.
参考答案:(1)V2O5+H2SO4=(VO2)2 SO4+H2O 不是
(2)2、1、2H+、2、2、2 H2O
(3)0.005NA
(4)B
本题解析:(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液,化学方程式为V2O5+H2SO4=(VO2)2 SO4+H2O;该反应中的各元素的化合价在反应前后未发生变化,所以不是氧化还原反应;
(2)VO2+V的化合价是+5价,产物中V的化合价是+4价,H2C2O4中C的化合价是+3价,二氧化碳中C的化合价是+4价,所以C的化合价整体升高2价,根据氧化还原反应中得失电子守恒,VO2+、VO2+的系数是2,H2C2O4,的系数是1,二氧化碳的系数是2,根据电荷守恒,反应物中的电荷小于产物中的电荷数,所以反应物中的空白应是H+,产物中的空白应是H2O,H+的系数是2,则水的系数是2;
(3)标准状况下气体112毫升,物质的量是0.005mol,即生成0.005mol的二氧化碳,转移电子的物质的量是0.005mol,电子转移的数目为0.005NA
(4)若用盐酸酸化,则盐酸中的氯离子有还原性,所以能否用盐酸酸化,还需知道VO2+ 和Cl2氧化性相对强弱或VO2+与Cl-的还原性的相对强弱,若VO2+ 氧化性强,则不能用盐酸酸化,否则会生成氯气,不能氧化草酸,答案选B。
考点:考查化学方程式的书写,氧化还原反应的判断及配平、计算、氧化还原反应规律的应用
本题难度:一般
5、选择题 物质的量之比为 2∶5 的锌与稀硝酸反应,若硝被还原的产物为 N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是(?)
A.1:4
B.1:5
C.2:3
D.2:5
参考答案:A
本题解析:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。该题是对硝酸的氧化性知识的考查,答题时注意电子守恒思想在氧化还原反应中的运用,有利于培养学生的逻辑推理能力,有利于提高学生的应试能力和学习效率。
本题难度:一般