1、选择题 现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-和NO3-的相互分离。相应的实验过程如下:
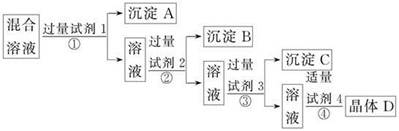
下列关于四种试剂顺序正确的是
A.氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液
B.硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液
C.氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液
D.硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液
参考答案:A
本题解析:Cl-可用AgNO3沉淀,SO42-可用Ba2+沉淀,由于Ag2SO4微溶于水,故SO42-的除去应在Cl-之前;由于加入的试剂是过量的,所以过量的AgNO3、BaCl2必须除去,可选用Na2CO3,而过量的Na2CO3可用稀硝酸来除去,所以正确答案为A项。
本题难度:一般
2、实验题 (8分)为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
实验要求
| 化学试剂
|
1.检验酒精中是否有水
| ?
|
2.区别CH4和C2H4两种无色气体
| ?
|
3.验证味精是否有食盐
| ?
|
4.除去Fe2O3中的Al2O3
| ?
|
供选择的化学试剂:
A.酸性高锰酸钾B.硝酸银溶液和硝酸C.氢氧化钠溶液D.无水硫酸铜粉末
参考答案:⑴D?⑵A?⑶B?⑷C
本题解析:检验水一般用无水硫酸铜;乙烯含有碳碳双键,能使溴水或酸性高锰酸钾溶液褪色;检验氯离子常用硝酸酸化的硝酸银溶液。氧化铝是两性氧化物,能溶液氢氧化钠或酸。
本题难度:一般
3、选择题 一定温度下,某物质在水中的溶解度为S,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是
①溶液中溶质的摩尔质量
②溶液中溶质和溶剂的质量比
③溶液的密度
④溶液的体积
A.①②
B.②③
C.①③
D.②④
参考答案:C
本题解析:
本题难度:困难
4、简答题 下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
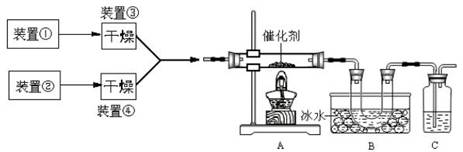
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是?。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因?。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
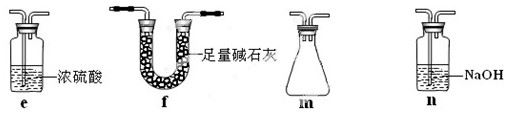
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是?(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进?(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。

请回答:装置⑦的作用可能是?;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是?。
参考答案:(1)实验室制取氨气的反应是,2NH4Cl+Ca(OH)2 CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕)
CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕) N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
(2)Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O
将e、m依次连接在B、C之间或将C装置换成f
(3)吸收未反应的NO? 60%
本题解析:(1))实验室制取氨气的反应是,2NH4Cl+Ca(OH)2 CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕)
CaCl2+NH3+2H2O 因为氨气催化氧化生成NO,2NO+O2=2NO2,2NO2(红棕) N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
N2O4(无色),正反应是放热,U型管底部的温度降低,上述平衡向右移动,NO2的浓度降低,颜色变浅。
(2)酸性K2Cr2O7溶液氧化未反应的二氧化硫,
Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O,此装置中存在明显不足是易发生倒吸且空气的水蒸气进入B中,得不到纯净干燥的三氧化硫,需在B、C之间依次加装置e、m,e装置防止空气的水蒸气进入B,m是安全瓶的起防止倒吸,或将C装置换成f装置,既可以吸收二氧化硫,还可防倒吸现象,防止水蒸气进入B中。
(3)装置⑥的作用是吸收未反应的的氨气,则⑦的作用是吸收未反应的NO;根据反应方程式有6NO—5N2,生成标准状况下11.2LN2,消耗NO的物质的量为0.6mol,原有NO的物质的量是22.4L/22.4L/mol=1mol,则NO转化率是60%。
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数,下列叙述正确的是
A.71?g氯气被还原得到的电子数为2NA
B.100?mL?l?mol?L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C.标准状况下,2.24?L乙烯中含有的σ键数目为0.5?NA
D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64?g金属时阳极失去的电子数小于2NA
参考答案:AC
本题解析:分析:A、根据电子守恒,71g氯气物质的量是1mol,反应得到2mol电子;
B、由于碳酸根在溶液中发生了水解,数目减少;
C、乙烯分子中含有5个σ键,2.24 L乙烯在标况下含有0.5molσ键;
D、阴极析出的是铜,64g铜物质的量是1mol,转移电子2mol.
解答:A、71g氯气的物质的量是1mol,含有2mol氯原子,被还原生成了氯离子,转移电子2mol,得到的电子数为2NA,故A正确;
B、碳酸钠溶液中,碳酸根发生了水解,导致碳酸根数目减少,含有的CO32-数小于0.1NA,故B错误;
C、乙烯的物质的量是0.1mol,含有0.1molσ键,2.24 L乙烯中含有的σ键数目为0.5 NA,故C正确;
D、由于铜的还原性大于银的,阳极银不会参与反应,故溶液中氧化性最强的阳离子是铜离子,阴极被还原的是铜离子,故64 g金属时阳极失去的电子数等于2NA,故D错误;
故选AC.
点评:本题考查阿伏伽德罗常数,注意弱酸根、弱碱根的水解,难度中等.
本题难度:一般