1、选择题 下列变化过程中,需吸收能量的是
A.H+H→H2
B.H+Cl→HCl
C.I2→I+I
D.C+O2→CO2
参考答案:C
本题解析:A、B形成化学键要放出能量,C拆开化学键要吸收能量,D断开O——O键需吸收能量,形成C-O键要放出能量,计算其差判断是吸收还是放出,而我们知道燃烧是放出能量.
本题难度:一般
2、选择题 下列变化过程需要吸收能量的是
A.2H2+O2=2H2O
B.CaO+H2O=Ca(OH)2
C.Cl+Cl→Cl2
D.N2→N+N
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列变化为放热的化学反应的是
A.H2O(g)=H2O(l)ΔH=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g)ΔH=+QkJ/mol(Q>0)
C.形成化学键时共放出862 kJ能量的化学反应
D.C(金刚石,s)=C(石墨,s)ΔH=-Q(Q>0)
参考答案:D
本题解析:水的状态变化不是化学反应,A选项错误;B选项是吸热反应,不符合题意;反应热取决于断裂反应物的化学键所消耗的能量和形成生成物的化学键所放出的能量的相对大小,C选项错误.
本题难度:简单
4、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);?ΔH=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
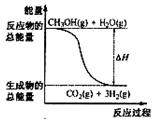
下列说法正确的是
A.CH3OH的燃烧热为—192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ·mol-1
参考答案:D
本题解析:试题分析:A错,因为氢气并不是稳定的生成物,即生成的应该是水,B错误,因为①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH大于0,所以反应物的总能量应该小于生成物的总能量,C错误,因为②中的热化学方程式表明,CH3OH转变成H2的过程一定要放出能量,D正确,因为CH3OH(l)变成CH3OH(g)需要吸收能量。
考点:热化学方程式
点评:本题考查了热化学方程式,有一定的难度。解题的关键在于掌握基本概念以及坐标图中各部分的含义。
本题难度:一般
5、选择题 同温同压下,下列各热化学方程式中反应热数值最小的是(均为吸热反应)
A.2A(l)+B(l)=2C(g);△H=+Q1KJ·mol-1
B.2A(g)十B(g)=2C(g);△H=+Q2KJ·mol-1
C.2A(g)十B(g)=2C(1);△H=+Q3KJ·mol-1
D.2A(l)十B(1)=2C(1);△H=+Q4KJ·mol-1
参考答案:C
本题解析:
本题难度:简单