1、选择题 常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol?L-1的Na2CO3溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3)
B.pH=11的Na2CO3溶液中:c(Na+)-c(CO32-)+c(HCO3-)═10-3-10-12
C.浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:CH3COO-离子浓度前者大于后者的10倍
D.0.1mol?L-1的NH4Cl溶液与0.1mol?L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)═c(Na+)>c(OH-)>c(NH4+)>c(H+)
参考答案:A.Na2CO3溶液,根据化学式可知存在元素的物质的量关系:n(Na)=2n(C),则应存在物料守恒:c(Na+)═2c(CO32-)+2c(HCO3-)+2c(H2CO3),故A错误;
B.常温下,pH=11的Na2CO3溶液中,c(OH-)=10-3mol/L,c(H+)=10-11mol/L,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),
则应有c(Na+)-2c(CO32-)+c(HCO3-)═(10-3-10-11)mol/L,故C错误;
C.CH3COOH为弱电解质,浓度越小,电离程度越大,则浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:CH3COO-离子浓度前者小于后者的10倍,故C错误;
D.0.1mol?L-1的NH4Cl溶液与0.1mol?L-1的NaOH溶液等体积混合生成NH3?H2O,NH3?H2O为弱电解质,部分电离,溶液呈碱性,溶液中存在c(Cl-)=c(Na+)>c(OH-)>c(NH4+)>c(H+),故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al
参考答案:C
本题解析:
本题难度:简单
3、填空题 某可溶性盐化学式为XY(其中X+为阳离子;Y―为阴离子),将一定量的该盐溶于足量的水中。
(1)若测得溶液的pH为3,则该盐溶液中离子浓度大小关系为:___________ ;
(2)若测得溶液的pH为11,则该盐与水反应的离子方程式为:_____________ ;
(3)若测得溶液的pH为13,则取0.1mol/L的HY溶液100mL中和等浓度的NaOH溶液至中性,所需 NaOH溶液的体积_____________100mL(填“>”、“<”、或“=”)。
参考答案:(1) c(Y-)>c(X+)>c(H+)>c(OH-)
(2) Y-+H2O HY+OH-
HY+OH-
(3)<
本题解析:
本题难度:一般
4、选择题 下列过程或现象与盐类水解无关的是( ? )
A.纯碱溶液滴入酚酞变红
B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.用氯化铵溶液除去铁锈
参考答案:B
本题解析:
本题难度:简单
5、选择题 关于小苏打水溶液的表述正确的是
[? ]
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有:NaHCO3=Na++HCO3-,HCO3-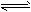 H++CO32-,H2O
H++CO32-,H2O H++OH-
H++OH-
参考答案:AD
本题解析:
本题难度:一般