1、选择题 水中加入下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液
B.NaOH溶液
C.KAl(SO4)2溶液
D.KI溶液
参考答案:D
本题解析:水是弱电解质,存在电离平衡H2O H++OH-。所以酸或碱都能抑制水的电离,而能发生水解的盐,则是促进水的电离,即A和B抑制水的电离,C促进水的电离,碘化钾比强酸强碱盐,不能水解,不会影响水的电离平衡,答案选D。
H++OH-。所以酸或碱都能抑制水的电离,而能发生水解的盐,则是促进水的电离,即A和B抑制水的电离,C促进水的电离,碘化钾比强酸强碱盐,不能水解,不会影响水的电离平衡,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是理解并掌握外界条件对水电离平衡影响,然后结合题干灵活运用即可。
本题难度:简单
2、选择题 常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
A.两清液混合,AgCl和AgI都沉淀
B.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
C.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主
D.若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
参考答案:A、饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,
饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,
等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6
明显,混合后,AgI必然沉淀,AgCl则不然.故A错误;
B、Ksp与温度有关,温度不变,Ksp不变,故B错误;
C、由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,C正确;
D、常温下,氯化银的溶解度为:1.342×10-5×143.5═0.001.92(g),c(Cl-)═1.342×10-5mol/L,0.1435克AgCl只有少量溶解,故c(Cl-)═1.342×10-5mol/L,故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 一定温度下,石灰浆中存在下列平衡:Ca(OH)2(s)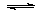 Ca2+(aq)+2OH-(aq),当向一定量的石灰浆中加入少量生石灰后并恢复到原来的温度,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰浆中加入少量生石灰后并恢复到原来的温度,下列说法正确的是
A.溶液中Ca2+离子数目减少
B.溶液中c(Ca2+)增大
C.溶液的pH增大
D.溶液中溶质的质量分数增大