1、选择题 将(NH4)2CO3加热到全部转化为气体后,将气体先通过过氧化钠,固体质量增加x g,再通过浓硫酸,液体质量增加y g;若先通过浓硫酸,液体质量增加z g,再通过过氧化钠,固体质量增加w g。则x、y、z、w由大到小的排列顺序是
A.z>y>x>w
B.w>z>y>x
C.y>z>w>x
D.x>y>z>w
参考答案:A
本题解析:
本题化学反应:(NH4)2CO3=2NH3+H2O+CO2
2Na2O2+2H2O=4NaOH+O2
2Na2O2+2CO2=2Na2CO3+O2
2NH3+H2SO4=(NH4)2SO4
设取1mol(NH4)2CO3,分解产生2molNH3、1molH2O、1molCO2
2Na2O2+2H2O=4NaOH+O2? △m
1mol? 2g
2Na2O2+2CO2=2Na2CO3+O2?△m
1mol? 28g
将气体先通过过氧化钠,固体质量增加x g,
X=2g+28g=30g
2NH3+H2SO4=(NH4)2SO4?△m
2mol? 34g
再通过浓硫酸,液体质量增加y g
Y=34g
若先通过浓硫酸,液体质量增加z=2mol×17g/mol+1mol×18g·mol-1=52 g,
再通过过氧化钠,固体质量增加w="28" g。
选A.
本题难度:简单
2、选择题 由红磷制取白磷可采用的方法是?(?)?
A.在空气中加热至416℃,使红磷升华
B.用CS2溶解,将红磷分出
C.加高温、高压,使红磷分出
D.隔绝空气,加热到416℃,使红磷升华,再冷却
参考答案:D






本题解析:红磷与白磷的区别。白磷白色蜡状不溶于水,溶于CS2 剧毒着火点40℃ , 易自燃密封,保存于冷水。红磷红棕色粉末不溶于水和CS2 无毒 着火点240℃密封,防止吸湿。
本题难度:简单
3、实验题 (9分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
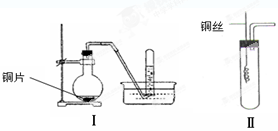
(1)铜与稀硝酸反应的化学方程式_____?_?。
(2)学生甲用装置Ⅰ探究铜与稀硝酸反应的气体产物。实验过程在烧瓶中观察到有红棕色气体产生,在试管中收集到无色气体。?烧瓶中产生红棕色气体的原因是
?(用方程式表示)。
(3)学生乙认为,甲用装置Ⅰ实验,无法说明问题。为了证明并观察到铜与稀硝酸反应的产物为NO,甲设计了如图Ⅱ所示的实验装置,选择下列药品,并按下列实验步骤完成该实验。请你根据他的思路,回答下列问题:
药品:稀硝酸锌粒石灰石固体
步骤:
①检查装置的气密性
②向试管中加入一定量CaCO3固体
③向试管中倒入过量的稀HNO3并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将导管插入试管内接近液面
⑤将铜丝插入到溶液中
⑥用注射器的针头穿过橡皮塞并向试管内推入氧气(或空气)
(ⅰ)步骤②目的是??;
(ⅱ)推入氧气或空气的目的是?;
(ⅲ)分别将等质量的铜片与等体积均过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出,这可能是Cu2+的浓度差异引起的,你同意这种看法吗?(填“同意”或“不同意”),原因是??。
参考答案:(9分)(1)3Cu + 8HNO3?3Cu(NO3)2? + 2NO↑+ 4H2O
(2)2NO+ O2 ?=2NO2
(3)(ⅰ)排除装置中的氧气?(ⅱ)检验生成的NO气体?
(ⅲ)不同意,铜片质量相同,该液体体积相同;生成的Cu2+浓度相同。
本题解析:(1)硝酸就有氧化性,能把铜氧化生成硝酸铜,方程式为3Cu + 8HNO3?3Cu(NO3)2? + 2NO↑+ 4H2O。
(2)NO极易被氧化生成红棕色NO2,方程式为2NO+ O2 ?=2NO2。
(3)①为防止NO被氧气氧化,所以必需排尽装置中的空气,乙醇利用碳酸钙和盐酸反应生成的CO2来排除装置中的氧气。
②通过氧气氧化NO来检验生成的NO气体。
③由于铜片质量相同,液体体积也相同,所以生成的Cu2+浓度相同,因此不是铜离子浓度差异引起的。
本题难度:一般
4、填空题 已知A、B、C、D、E、F是含有同一种元素的化合物,其中F能使红色湿润石蕊试纸变蓝色,它们之间能发生如下反应:
① A+H2O → B+C?② C+F → D?③? D+NaOH → F+E+H2O
(1)写出它们的化学式:D_______________,F_______________。
(2)写出①反应的化学方程式:_______________________________
(3)写出反应③的离子方程式:___________________________。
(4)工业生产C的过程中有如下一步反应:即F经催化氧化生成B和H2O,写出该步反应的化学方程式:________________________________。
参考答案:(1)NH4NO3? NH3?(2)3NO2 + H2O= 2HNO3+ NO?
(3)NH4++ OH- NH3 ↑+ H2O?(4)4NH3 + 5O2
NH3 ↑+ H2O?(4)4NH3 + 5O2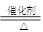 ?4NO + 6H2O
?4NO + 6H2O
本题解析:F能使红色湿润石蕊试纸变蓝色则F为NH3;A、B、C、D、E、F是含有同一种元素的化合物而且有上述关系,则A是NO2,B为NO,C为HNO3,D为NH4NO3,E为NaNO3.(1)化学式:D: NH4NO3; F: NH3;(2)①反应的化学方程式3NO2 + H2O= 2HNO3+ NO;(3)反应③的离子方程式NH4++ OH- NH3 ↑+ H2O.(4)工业生产HNO3过程中NH3经催化氧化生成NO和H2O的反应方程式为4NH3 + 5O2
NH3 ↑+ H2O.(4)工业生产HNO3过程中NH3经催化氧化生成NO和H2O的反应方程式为4NH3 + 5O2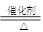 ?4NO + 6H2O。
?4NO + 6H2O。
本题难度:一般
5、计算题 (10分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3 = NaNO2+NaNO3+CO2↑? ①
NO+NO2+Na2CO3 = 2NaNO2+CO2↑? ②
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用纯碱溶液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
①若该混合气体通入纯碱溶液时要求被完全吸收,则x的取值范围应为?。
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×106m3(标准状况)含NOx(x取值范围满足①中要求)体积分数为0.1%的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式。
参考答案:(10分)(1)0.30(3分)(2)① 1.5≤x<2 (3分),② y=1.01x-0.825(4分)
本题解析:略
本题难度:简单