1、实验题 (12分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
________________________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
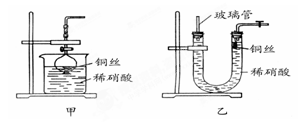
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________________________________(写化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是_______________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是__________________________________。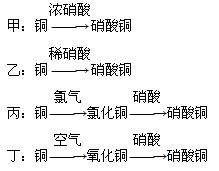
2、填空题 (9分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是?。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是?。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是?。
(3)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g)?△H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g)?△H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H=?。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)?△H?-574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
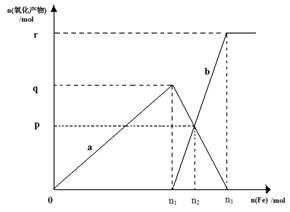
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。? b是?n3 =?p=?
3、选择题
Au+HNO3+3HCl===AuCl3+NO↑+2H2O
玻尔走后,纳粹分子窜进他的实验室,那瓶溶有金质奖章的溶液就在纳粹眼皮底下,纳粹分子却一无所知,多么高明的隐藏奖章的方法啊!德军战败后,玻尔回到自己的实验室,他从溶液中提取出金,重新铸成了诺贝尔奖章,新奖章显得更加光彩夺目。则下面所列方法中,你认为不能从溶有黄金的王水中提取出金的是________。
A.用铁置换
B.电解其水溶液
C.先蒸发水分后灼烧固体
D.渗析或过滤
4、计算题 (8分)铜能与稀硝酸反应,反应方程式为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,当有9.6克Cu参加反应时,
求:
(1)产生气体在标准状况下的体积
(2)被还原的硝酸的质量
5、计算题 取5.64gCu(NO3)2无水晶体,强热使其分解,得到NO2、O2和2.32固体氧化物。将气体用水充分吸收后,还有气体剩余,同时得到100mL溶液。请通过计算确定:(写出计算过程)
(1)所得溶液的物质的量浓度;
(2)残留固体的成分和质量分别是多少克?