| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《水的电离平衡》高频试题强化练习(2017年最新版)(二)
参考答案:B 本题解析:试题分析:混合后溶液pH=7,n(H+)=n(OH-),即 本题难度:一般 3、选择题 室温时,柠檬水溶液的pH是3,其中的c(OH-)是 |
参考答案:D
本题解析:Kw=C(H+)×c(OH-)=10-14mol/L C(H+)=10-3mol/L 所以c(OH-)=10-11mol/L
本题难度:简单
4、选择题 25℃时,某氯化铵溶液pH=4,下列说法正确的是
A.c(OH¯)=1×10¯10mol·L¯1
B.c(NH4+)>c(Cl¯)>c(H+)>c(OH¯)
C.c(NH3·H2O)=c(NH4+)
D.c(H+)+c(NH4+)=c(Cl¯)+ c(OH¯)
参考答案:AD
本题解析:pH=4,则氯化铵溶液c(H+)=10-4mol?L-1,由于溶液中c(H+)?c(OH-)=Kw、25℃时Kw =10-14,则该溶液中c(OH-)= 10-10mol?L-1,故A正确;电离程度:NH4Cl>H2O,氯化铵是强酸弱碱盐,铵根离子能在水中部分水解,与水电离出的氢离子反应生成一水合氨,促进水的电离平衡右移,而氯离子不能水解,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;铵根离子的水解程度很弱,则该溶液中c(NH4+)>c(NH3?H2O),故C错误;该溶液中含有四种离子:Cl-、NH4+、H+、OH-,溶液中呈电中性,则c(NH4+)+c(H+)=c(OH-)+c(Cl-),故D正确。
考点:考查溶液的pH、水的离子积、盐类水解、溶液中粒子浓度大小关系等。
本题难度:简单
5、选择题 12.有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的1/10倍
参考答案:BD
本题解析:A项如果醋酸的电离程度相等,则物质的量浓度c(甲)=10c(乙),实际上乙的电离程度大于甲,所以c(甲)>10c(乙);B项甲中水电离出的氢离子=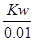 mol/L,乙中水电离出的氢离子浓度=
mol/L,乙中水电离出的氢离子浓度=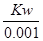 mol/L,所以甲中由水电离产生的H+的物质的量浓度是乙的0.1倍;C项因为c(甲)>10c(乙),所以中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲);D项甲中氢氧根离子浓度=
mol/L,所以甲中由水电离产生的H+的物质的量浓度是乙的0.1倍;C项因为c(甲)>10c(乙),所以中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲);D项甲中氢氧根离子浓度=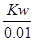 mol/L,乙中氢氧根离子浓度=
mol/L,乙中氢氧根离子浓度=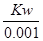 mol/L,所以甲氢氧根离子浓度是乙的0.1倍。
mol/L,所以甲氢氧根离子浓度是乙的0.1倍。
考点:弱电解质在水溶液中的电离平衡;pH的定义
点评:本题考查了弱电解质的电离,明确弱电解质溶液的浓稀与其电离程度之间的关系是解答本题的关键。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《离子反应》.. | |