1、实验题 有机合成在制药工业上有着极其重要的地位。现用硝基苯制取苯胺,再用苯胺
制得无色晶体乙酰苯胺(具有退热镇痛作用的药物)。
化学原理为:

苯胺?乙酸?乙酰苯胺
② 相关物质的物理常数
物?质
| 相对分
子质量
| 状?态
| 熔点
(℃)
| 沸点
(℃)
| 溶?解?度(g)
|
水
| 乙?醇
|
苯 胺
| 93
| 无色液体
| -6
| 184
| 3.42(20℃)
| 任意比混溶
|
冰醋酸
| 60
| 无色液体
| 17
| 118
| 任意比混溶
| 任意比混溶
|
乙酰苯胺
| 135
| 白色片
状固体
| 114
| 304
| 0.56(20℃)、3.45(50℃)
5.20(100℃)
| 36.9(20℃)
|
③ 制备乙酰苯胺的装置如下图所示:

④ 制备方法和过程:

已知:Ⅰ苯胺易被氧化,加入少量锌可防止氧化
Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是?。
(2)步骤2中将反应液倒入水中的目的是?。
(3)步骤3中洗涤剂最好选择?。
A.冷水? B.热水? C.15%的乙醇溶液? D.NaOH溶液
(4)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→?→冷却结晶→抽滤→洗涤→干燥。
(5)上述制备过程的产率是?。
参考答案:(1)? H2O?
(2)洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出?
(3)A?
(4)趁热过滤?
(5)35.29% (其中(1)(3)小题各1分,其余每小题 2分)
本题解析:(1)?这几种反应物和生成物在105℃的条件下,只能蒸出H2O 。
(2)因为在水中,相比而言,乙酰苯边的溶解度较小。所以可以用来洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出。
(3)乙酰苯胺在冷水中的溶解度会更小。所以选A?
(4),因为怕在过滤过程中有损失,所以要趁热过滤?
(5) 依据化学方程式,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g
因此,上述制备过程的产率是:
本题难度:一般
2、选择题 下列说法不正确的是
A.纤维素的水解产物能与新制的Cu(OH)2悬浊液生成红色沉淀
B.正戊烷和环戊烷互为同分异构体
C.在酸性条件下,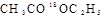 的水解产物是
的水解产物是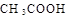 和
和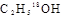
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
参考答案:B
本题解析:纤维素的水解产物是葡萄糖,葡萄糖属于还原糖分子中含有醛基可以与新制Cu(OH)2悬浊液生成红色沉淀,A正确不选;正戊烷的分子式为C5H12环戊烷的分子式为C5H10,分子式不同不是同分异构体,B错误;在浓硫酸存在下,苯的硝化反应属于取代反应,D正确,所以答案选B。
本题难度:一般
3、选择题 化学在开发新能源、保护环境等方面有着极其重要作用.下列各项措施中,不利于节能减排和改善环境的是
A.加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
B.对聚乙烯等塑料垃圾进行深埋或倾倒入海
C.H2是理想的绿色能源,但最好不用电解水的方法进行获得
D.推广可利用太阳能、风能的城市照明系统
参考答案:B
本题解析:分析:减少具有污染性气体的排放,开发使用新能源有利于节能减排和改善环境,而有害垃圾的随意丢弃和掩埋则不利于改善环境.
解答:A、加速建设地铁、轻轨等轨道交通,减少汽车尾气排放对保护环境有着极其重要作用,有利于节能减排和改善环境,故A正确;
B、聚乙烯等塑料垃圾不宜降解,深埋在地下会改变土壤结构,不利于改善环境,故B错误;
C、不用电解水的方法获得氢气可减少能源的消耗,对改善环境起到积极的作用,故C正确;
D、推广可利用太阳能、风能的城市照明系统,减少传统能源的使用,有利于改善环境,故D正确.
故选B.
点评:本题考查常见的生活环境的污染及治理,题目难度不大,注意基础知识的积累.
本题难度:简单
4、选择题 某有机化合物3.2 克在氧气中充分燃烧,将生成物依次通入盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,实验测得装有浓硫酸的洗气瓶增重3.6克,盛有碱石灰的干燥管增重4.4克。则下列判断正确的是(?)
A.肯定含有碳、氢、氧三种元素
B.肯定含有碳、氢元素,可能含有氧元素
C.肯定含有碳、氢元素,不含氧元素
D.不可能同时含有碳、氢、氧三种元素
参考答案:A
本题解析:3.2g该有机物在氧气中燃烧后生成的产物依次通过浓硫酸和碱石灰,分别增重3.6g和4.4g,生成水的质量是3.6g,所以氢原子的物质的量是0.4mol,含有氧原子的物质的量是0.2mol。生成的二氧化碳的质量是4.4g,碳原子的物质的量是0.1mol,根据碳原子守恒,可以知道有机物中含有0.1mol碳原子和0.4mol氢原子,根据质量守恒,参加反应的氧气的质量是4.8g,物质的量是0.15mol,即0.3mol的氧原子,根据氧原子守恒,有机物质中含有氧原子0.1mol,一定含有碳元素和氢元素,所以答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。旨在培养学生分析、归纳、总结问题的能力。该题的关键是利用好守恒法。
本题难度:一般
5、选择题 形成化合物种数最多的元素在周期表中处于
A.第四周期ⅧA族
B.第二周期ⅣA族
C.第三周期ⅣA族
D.第三周期ⅦA族
参考答案:B
本题解析:略
本题难度:简单