1、选择题 下列物质不属于有机物的是
A.CH4
B.C2H4
C.KSCN
D.C2H5OH
参考答案:C
本题解析:分析:根据含有碳元素的化合物叫有机化合物,简称有机物;碳的氧化物、碳酸盐、碳酸虽含碳,但其性质与无机物类似,因此把它们看作无机物;据此进行分析判断.
解答:A.CH4是一种含碳的化合物,属于有机物,故A错误;
B.乙烯是一种含碳的化合物,属于有机物,故B错误;
C.KSCN常归为无机物,故C正确;
D.乙醇是一种含碳的化合物,属于有机物,故D错误.
故选C.
点评:本题考查有机物的概念,难度不大,掌握有机物与无机物的概念、特征等是正确解答此类题的关键.
本题难度:一般
2、选择题 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列系正确的是
A.离子的还原性:Y2->Z-
B.质子数:c>b
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
参考答案:A
本题解析:略
本题难度:简单
3、选择题 x、y为两元素的原子,x的阴离子与y的阳离子的电子层结构相同,由此可知
A.x的原子半径大于y的原子半径
B.x的第一电离能小于y 的第一电离能
C.x的金属性大于y的金属性
D.x的电负性大于y的电负性
参考答案:D
本题解析:x的阴离子与y的阳离子的电子层结构相同,则X是非金属,Y是金属,位于X的下一周期。同周期自左向右原子半径逐渐减小,非金属性逐渐减弱。所以Y的原子半径大于X的,A不正确。金属性越强,第一电离能越小,B不正确,C也不正确。非金属性越强,电负性越大,所以选项D正确。答案选D。
本题难度:一般
4、简答题 (8分)已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。回答下列问题:
(1)元素D在周期表中的位置是?。
(2)画出E的阴离子的结构示意图:?。
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式:?。
写出一种由A、C、D三种元素组成的共价化合物的化学式:??。
(4)将9 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中,
完全吸收后,溶液中大量存在的阴离子是?。
参考答案:(8分)?(1)第2周期ⅥA族?(1分)
(2) 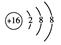 ?(1分)
?(1分)
(3) NH4HCO3或(NH4)2CO3(2分)?
HNO3或HNO2(2分)
(4)? CO32-和 HCO3-(2分,缺一项不得分)
本题解析:A是原子半径最小的元素,所以A是H元素;,B原子的最外层电子数是内层电子数的2倍,所以B最外层电子是4个,有2层电子,B是C元素; E的单质为黄色晶体,易溶于二硫化碳,E是S元素;E元素与D元素同主族,则D是O元素;C、D在元素周期表中处于相邻的位置,则C是N元素。根据以上分析得:
(1) 元素D在周期表中的位置是第2周期ⅥA族;
(2)E的阴离子即S2-的结构示意图: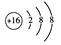
(3)由A、B、C、D四种元素组成的离子化合物是NH4HCO3或(NH4)2CO3;由A、C、D三种元素组成的共价化合物是HNO3或HNO2;
(4)9 g C单质在足量的氧气中燃烧,生成0.75mol的CO2,与1mol的NaOH反应生成的产物可通过计算判断。 设产物中NaHCO3、Na2CO3的物质的量分别是x、y,根据元素守恒得x+2y=1mol,x+y=0.75mol,解得x=0.5mol,y=0.25mol,所以完全吸收后,溶液中大量存在的阴离子是CO32-和 HCO3-。
本题难度:一般
5、选择题 下列物质的性质比较,正确的是( ) ?
A.酸性:H2SO4>HClO4>HBrO4
B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl
D.气态氢化物稳定性:HF>H2O>PH3
参考答案:B
本题解析:A、非金属性Cl>Br>S,对应的最高价氧化物的水化物的酸性为HClO4>HBrO4>H2SO4,故A错误;
B、金属性Rb>K>Na,则对应的最高价氧化物的水化物的碱性为NaOH<KOH<RbOH,故B错误;
C、同周期,从左向右非金属性在增强,则非金属性P<S<Cl,故C错误;
D、非金属性F>O>N,则气态氢化物的稳定性为HF>H2O>NH3,故D正确;
故选D。
点评:本题考查非金属性的比较及元素周期律,熟悉非金属元素的性质变化规律及非金属性的比较方法即可解答,难度不大。
本题难度:简单