1、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
| X
| Y
| Z
|
初始浓度/mol·L-1
| 0.1
| 0.2
| 0
|
平衡浓度/mol·L-1
| 0.05
| 0.05
| 0.1
|
下列说法错误的是高(?)
A.反应达到平衡时,X的转化率为50%
B.上述反应为X+3Y  2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数不变
D.若改变温度反应的平衡常数变大,则一定为升高温度
2、选择题 可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其它条件不变时,混合气体平均相对分子质量不再改变;④保持其它条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,混合气体的密度保持不变;⑦正反应速率v(H2) = 0.6 mol/(L·min),逆反应速率v(NH?3) = 0.4 mol/(L·min)
A.全部
B.①③④⑤
C.②③④⑤⑦
D.③⑤⑥⑦
3、填空题 甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
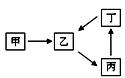
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是? ?;
?;
②丙溶液中通入少量CO2生成丁的离子方程式是?。
(2)若2乙(g) + 甲(g)  ?2丙(g),是工业生产中重要反应之一。
?2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
温度/℃
| 400
| 450
| 500
| 550
| 600
| 650
|
转化率/%
| 99.2
| 97.5
| 93.5
| 85.6
| 73.7
| 58.5
|
①该反应的△H?0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1?K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是?;
②已知:R(s) + 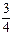 O2(g) =
O2(g) = 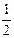 R2O3(s)? △H=-834.8 kJ·mol-1
R2O3(s)? △H=-834.8 kJ·mol-1
Mn(s) + O2(g) = MnO2(s)? △H=-520.9 kJ·mol-1
写出R的单质与MnO2反应的热化学方程式?。
4、填空题 (6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 ?(填“吸热”或“放热”)反应。

(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
5、填空题 830K时,在密闭容器中发生下列可逆反应:

 CO(g)+H2O(g)
CO(g)+H2O(g) CO2(g)+H2(g);△H<0?试回答下列问题:
CO2(g)+H2(g);△H<0?试回答下列问题:
 (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=?.
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=?.
 (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),?此时v(正)正)?v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是?。
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),?此时v(正)正)?v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是?。
 (3)若降低温度,该反应的K值将?(均填“增大”“减小”或“不变”)。
(3)若降低温度,该反应的K值将?(均填“增大”“减小”或“不变”)。