1、选择题 铁锈的成分中含有铁的氧化物、铁的氢氧化物.研究证明,铁器的生锈与大气中的氧气、水蒸气有关.下列做法中最有利于减缓铁器生锈的是
[? ]
A.铁锅用完后用水刷洗干净其表面的油污
B.久置不用的铁刀涂抹凡士林在空气中保存
C.将铁壶盛水后保存
D.铁勺、铁铲放在阴湿处保存
参考答案:B
本题解析:
本题难度:简单
2、填空题 电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是
_______(填序号)。

a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2OCH3CH2OH+CH3COOH
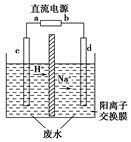
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入________(填化学式),电极反应式为________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
参考答案:(1)2Cu+H2O-2e-=Cu2O+2H+ 2H++2e-=H2↑ (2)d (3)①CH4 CH4-8e-+10OH-=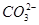 +7H2O 不变 ②1.9
+7H2O 不变 ②1.9
本题解析:(1)由于阳极材料为铜,所以铜本身失电子被氧化,由题意知氧化产物为Cu2O,可得阳极反应式为2Cu+H2O-2e-=Cu2O+2H+,阴极上阳离子放电,即溶液中H+被还原成清洁能源H2。
(2)左半区是原电池装置,发生的是铁的吸氧腐蚀,负极(Fe):Fe-2e-=Fe2+,正极(Cu):O2+2H2O+4e-=4OH-。右半区是电解装置,阳极(Fe):Fe-2e-=Fe2+,阴极(Cu):2H++2e-=H2↑,由于电解引起腐蚀的速率远大于吸氧腐蚀的速率,因此最先观察到变成红色的区域是④区,故选项a、b、c均错误。
(3)①根据电解液中阳离子的迁移方向,可知c为阳极,d为阴极,因此直流电源上a为正极,通入O2,b为负极,通入CH4,在碱性条件下CH4的氧化产物为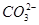 ,由此可写出此电极的电极反应式。在电解过程中,由于
,由此可写出此电极的电极反应式。在电解过程中,由于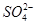 没有参与放电,且阳离子交换膜不允许阴离子自由通过,因此根据质量守恒可得阴极区Na2SO4的物质的量不变。
没有参与放电,且阳离子交换膜不允许阴离子自由通过,因此根据质量守恒可得阴极区Na2SO4的物质的量不变。
②阴极区发生还原反应,即CH3CHO转化成CH3CH2OH,设生成的乙醇为x kg,根据碳原子守恒可得关系式:
CH3CHO ~ CH3CH2OH
44? ? 46
3 000×103÷106×60%? x
解得x≈1.9。
本题难度:一般
3、选择题 将铁制零件与下列哪种金属或非金属接触时,可以减少空气和水对铁的腐蚀:
A.铜
B.银
C.石墨
D.锌
参考答案:D
本题解析:略
本题难度:简单
4、填空题 锂离子电池的广泛应用使回收利用锂资源成为重要课题.某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、碳粉和铝箔)进行资源回收研究,设计实验流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.

(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是______.
(2)写出生成沉淀X的离子方程式______.
(3)写出反应②的化学反应方程式______.
(4)反应③在实际操作中采用加入过量的Na2CO3固体而不是Na2CO3溶液,这样做的目的是______,操作过滤Ⅲ分离出滤渣Li2CO3后所得滤液中的主要成份为______.(写化学式)
参考答案:第一步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第二步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第三步是LiMn2O4在酸性环境下能被空气中的氧气氧化发生的氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后一步加入碳酸钠之后所得的滤液主要成分为硫酸钠;
(1)粉碎废料,能增大废料与氢氧化钠溶液的接触面积,加快反应速率.
故答案为:增大接触面积,加快反应速率.
(2)四羟基合铝酸钠与过量二氧化碳反应得产物是Al(OH)3沉淀和碳酸氢钠,
所以离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(3)在酸性环境下,LiMn2O4能被空气中的氧气氧化,生成二氧化锰、硫酸锂和水,所以化学方程式为:
4LiMn2O4+2H2SO4+O2=8MnO2+2Li2SO4+2H2O.
故答案为:4?LiMn2O4+2?H2SO4+O2=8MnO2+2?Li2SO4+2H2O.
(4)碳酸钠溶液中含有水,能增大碳酸锂的溶解,而使溶液中的锂离子沉淀不完全,所以用碳酸钠固体不用碳酸钠溶液;通过上面分析知,最后所得滤液中的主要成分为硫酸钠.
故答案为:使溶液中的Li+沉淀完全,减少Li2CO3的溶解,Na2SO4.
本题解析:
本题难度:一般
5、选择题 某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a 的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b 示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是
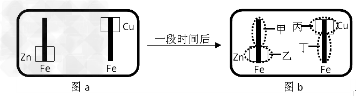
[? ]
A.甲区发生的电极反应式:Fe-2e-= Fe2+?
B.乙区产生Zn2+
C.丙区呈现红色?
D.丁区呈现蓝色
参考答案:A
本题解析:
本题难度:一般