1、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
A.加入少量稀NaOH溶液
B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体
D.加入少量Na2CO3浓溶液
参考答案:B
本题解析:“减缓反应速率”则氢离子的浓度应减小;而“又不影响生成H2的总量”则氢离子的总量应保持不变,故答案为B。
点评:本题考查影响反应速率的因素,属于基础题。熟记影响反应速率的因素即可解答。
本题难度:一般
2、选择题 下列变化能加快反应速率,且反应物活化分子百分数增加的是
①?升高温度 ②使用证催化剂? ③增大压强? ④增加浓度
A ②④? ?B? ③④?C? ①② ?D ②③
?B? ③④?C? ①② ?D ②③
参考答案:C
本题解析:略
本题难度:简单
3、选择题 可逆反应A(g)+3B(g) 2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
A.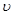 (A)="0.5" mol/(L·S) B.
(A)="0.5" mol/(L·S) B.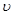 (B)=" 0.6mol/(L·S)"
(B)=" 0.6mol/(L·S)"
C.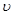 (C)="0.8" mol/(L·S) D.
(C)="0.8" mol/(L·S) D.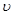 (D)= 0.9mol/(L·S)
(D)= 0.9mol/(L·S)
参考答案:D
本题解析:同一个化学反应,用不同的物质表示其反应速率时,数值可能不同,但表示的意义是相同的。所以在比较反应速率快慢时,应该换算成用同一种物质表示,然后才能直接比较速率数值大小。根据速率之比是相应化学计量数之比可知,如果都用物质A表示,则分别是0.5 mol/(L·S)、0.2 mol/(L·S)、0.4 mol/(L·S)、0.9mol/(L·S),所以答案选D。
本题难度:一般
4、填空题 t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(恒容),发生如下反应:
3A(g)+ B(g )  ?xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:
?xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:
⑴从开始反应至达到平衡状态,以B表示的平均反应速率为??
⑵x=??
⑶若继续向原平衡混合物的容器中通入适量氦气(假设氦气和A、B、C都不反应)后,原化学平衡________(填字母)?
A.向正反应方向移动? B.向逆反应方向移动?C.不移动? D.无法判断
⑷若向原平衡混合物的容器中再充入3molA和1molB,在t℃时达到新的平衡,此时B的物质的量为n(B)______1.6mol。(填“>”、“<”、或“=”)
⑸如果将amolA、bmolB、cmolC在相同温度和容器中进行反应,欲使反应达到平衡时C的物质的量浓度分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的等量关系式:__________________、__________________(a与c及b及c的关系式)
参考答案:(12分)⑴0.05mol·L-1·min(2分)⑵4(2分)⑶C(2分)⑷=(2分)
⑸a+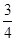 c="3" (2分) b+
c="3" (2分) b+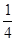 c=1(2分)
c=1(2分)
本题解析:(1)消耗B的物质的量是1mol-0.8mol=0.2mol,所以B表示的反应速率是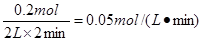 。
。
(2)C的浓度为0.4mol·L-1,则生成C的物质的量是0.8mol。因为物质的变化量之比是化学计量数之比,所以x=4。
(3)若继续向原平衡混合物的容器中通入适量氦气,压强增大,但物质的浓度是不变的,因此平衡不移动,答案选C。
(4)反应前后体积是不变的,所以若向原平衡混合物的容器中再充入3molA和1molB,则平衡是等效的,所以n(B)=1.6mol。
(5)该反应是体积不变的可逆反应,所以只要满足最初A和B的物质的量浓度满足3:1即可满足平衡是等效的。则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的等量关系式a+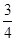 c=3、b+
c=3、b+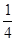 c=1。
c=1。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的难点是等效平衡的判断和计算。
本题难度:一般
5、选择题 工业上制备纯硅反应的化学方程式为SiCl4(g) + 2H2(g)  Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
A.升温
B.加压
C.减压
D.加催化剂