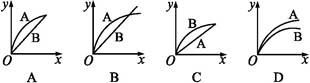
1、选择题 进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x—时间,y—锥形瓶中碳酸钙减少的质量)( )
2、填空题 (16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的?H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 。
A.升高温度 B.降低压
C.加入更多的SiO2 D.充入N2
某温度下,测得该反应中N2和CO各个时刻的浓度如下,
时间/min
| 0
| 5
| 10
| 15
| 20
| 25
| 30
| 35
| 40
| 45
|
N2浓度/mol·L-1[
| 4.00
| 3.70
| 3.50
| 3.36
| 3.26
| 3.18
| 3.10
| 3.00
| 3.00
| 3.00
|
CO浓度/mol·L-1
| 0.00
| 0.90
| 1.50
| 1.92
| 2.22
| 2.46
| 2.70
| —
| —
| —
|
求0—20 min内N2的平均反应速率V(N2 )= ,该温度下,反应的平衡常数K= 。
3、实验题 下图为制取乙酸乙酯的实验装置图。回答下列问题:
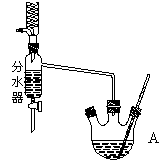
揭示实验原理
乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右 图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。
4、选择题 下述实验不能达到预期实验目的是( )
| 序号 | 实验内容 | 实验目的
A
将2.5g?CuSO4?5H2O溶解在97.5g?水中
配制质量分数为1.6%的CuSO4溶液
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
室温下,用pH试纸测定浓度为0.1mol?L-1 NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
|
A.A
B.B
C.C
D.D
5、简答题 (14分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
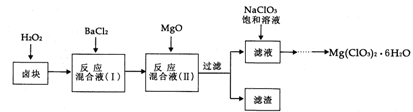 ?
?
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
回答下列问题:
(1)加速卤块在H2O2溶液中溶解的措施有:??(写出一条即可)。
(2)加入MgO的作用是?;滤渣的主要成分为?。
(3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为??,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为①蒸发结晶;②?;③____;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为: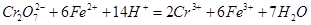 。
。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-):?;
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)?。