1、选择题 下表列举的各组事实中存在因果关系的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:陈述Ⅰ和陈述Ⅱ相比较,如果存在因果关系,必须是陈述Ⅰ是陈述Ⅱ变化的原因,能解释陈述Ⅱ的结论正确,分析各项性质对比成因即可做出判断.
解答:A、因为高纯单质硅具有半导体性能,所以制成的光电池才可将光能直接转化为电能,故A正确;
B、钠原子核外电子数比铝少,不是钠的金属性比铝强的原因,失电子的难易是钠的金属性比铝强的原因,故B错误;
C、氯的非金属性比碘强,说明氯气氧化性比碘单质强,但I2与KClO3反应生成Cl2和KIO3,是利用了KClO3的氧化性把I2氧化为KIO3,本身被还原为氯气,此反应中说明碘单质的还原性比氯气强,前后无因果关系,故C错误;
D、N2+3H2≒2NH3是放热反应,降低温度有利于平衡正向进行,生成更多的氨气,但温度低速率小,工业合成氨的反应在高温下进行的原因是提高速率同时催化剂在此温度下活性最大,所以前后无因果关系,故D错误;
故选A.
点评:本题考查了元素化合物的性质及原因,主要考查晶体硅的导电性应用、金属活泼性的比较依据、氧化还原反应的规律应用、工业合成氨条件选择的原因.
本题难度:一般
2、选择题 下列叙述正确的是
①久置于空气中的氢氧化钠溶液,加硫酸时有气体产生
②浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
A.①④⑤
B.①⑤⑥
C.②③④
D.④⑤⑥
参考答案:B
本题解析:分析:①久置于空气中的氢氧化钠溶液变为碳酸钠,根据碳酸钠的性质来回答;
②浓硫酸具有酸性、吸水性、脱水性和强氧化性;
③二氧化硅可以和HF酸反应;
④水晶的主要成分是二氧化硅;
⑤浓硫酸具有酸性、吸水性、脱水性和强氧化性;
⑥氯化铁溶液中铁离子水解,加热促进水解进行.
解答:①久置于空气中的氢氧化钠溶液变为碳酸钠,碳酸钠可以和硫酸反应生成硫酸钠、水以及二氧化碳,故①正确;
②浓硫酸具有吸水性和强氧化性,浓硫酸可用于干燥中性、酸性且不具有还原性的气体,不能干燥还原性的碘化氢气体,不能干燥碱性气体如氨气等,故②错误;
③二氧化硅可以和HF酸反应、和强碱溶液反应,CO2是酸性氧化物,和强碱溶液反应,不能与任何酸反应,故③错误;
④玻璃、水泥主要成分是硅酸盐,都是硅酸盐制品,水晶的主要成分是二氧化硅,不属于硅酸盐制品,故④错误;
⑤浓硫酸具有酸性、吸水性、脱水性和强氧化性,蔗糖炭化的演示实验中,会看到变黑现象,浓硫酸既体现了其强氧化性又体现了其脱水性,故⑤正确;
⑥氯化铁溶液中铁离子水解,加热促进水解进行,氧化铁胶体加热会聚沉,均产生红褐色沉淀氢氧化铁,氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质三氧化二铁,故⑥正确.
故选B.
点评:本题考查学生元素和化合物的性质知识,注意平时知识的积累是解题的关键,可以根据所学知识来回答,难度不大.
本题难度:困难
3、选择题 将0.1mol无水硫酸铜固体于强热下完全分解,得到Cu2O与SO3、SO2、O2的混合气体,该混合气体的平均式量可能为
A.32
B.48
C.64
D.72
参考答案:C
本题解析:分析:CuSO4分解得到Cu2O、SO3、SO2、O2,根据质量守恒定律可知,混合气体的总质量一定,利用硫原子守恒可知,硫的氧化物的物质的量之和为0.1mol,故混合气体的平均式量取决于氧气的物质的量,反应中铜元素的化合价降低,一定会有元素化合价升高,一定有氧气生成,利用极限法分析,根据电子转移守恒可知,当产生的气体为SO3和O2时,O2的 物质的量最小,混合气体的物质的量最小,平均式量最大;产生的气体为O2和SO2时,O2的物质的量最大,混合气体的物质的量最大,平均式量最小;
根据铜原子守恒计算Cu2O的物质的量,再根据m=nM计算Cu2O的质量,进而计算混合气体的物质的量,根据极限法,利用电子转移守恒计算氧气的物质的量,进而计算平均式量的极值,据此判断.
解答:CuSO4分解得到Cu2O、SO3、SO2、O2,根据质量守恒定律可知,混合气体的总质量一定,利用硫原子守恒可知,硫的氧化物的物质的量之和为0.1mol,故混合气体的平均式量取决于氧气的物质的量;
根据铜原子守恒可知,n(Cu2O)=0.05mol,故m(Cu2O)=0.05mol×144g/mol=7.2g,
故混合气体的质量为:0.1mol×160g/mol-7.2g=8.8g,
反应中铜元素的化合价降低,一定会有元素化合价升高,一定有氧气生成,根据电子转移守恒可知:
①当产生的气体为SO3和O2时,O2的物质的量最小,混合气体的物质的量最小,平均式量最大,由电子转移守恒可知,此时O2的物质的量为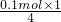 =0.025mol,由硫原子守恒可知n(SO3)=0.1mol,故混合气体的平均式量最大值为
=0.025mol,由硫原子守恒可知n(SO3)=0.1mol,故混合气体的平均式量最大值为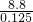 =70.4;
=70.4;
②当产生的气体为O2和SO2时,O2的物质的量最大,混合气体的物质的量最大,平均式量最小,由硫原子守恒可知n(SO2)=0.1mol,由电子转移守恒可知,此时O2的物质的量为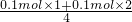 =0.075mol,故混合气体的平均式量最小值为
=0.075mol,故混合气体的平均式量最小值为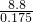 =50.3;
=50.3;
由于实际混合气体是SO3、SO2、O2三种气体的混合气体,故其平均式量应该在50.3~70.4之间,
故选C.
点评:本题考查混合物的有关计算,难度中等,注意利用极限法确定极值进行解答,关键是确定混合气体物质的量的极值.
本题难度:一般
4、选择题 等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是:
A.1 :1
B.3 :4
C.2 :3
D.4 :3
参考答案:B
本题解析:1mol铁和盐酸反应生成1mol氢气,而1mol铁和水蒸气反应生成氢气是4/3mol,所以答案选B。
本题难度:困难
5、选择题 30mL0.05mol/LNa2SO3溶液恰好与50mL0.02mol/LKXO4溶液完全反应转化为Na2SO4.则X元素在产物中的化合价是
A.+2
B.+3
C.+4
D.+5
参考答案:C
本题解析:分析:Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;KXO4中X元素发生还原反应,令X元素在产物中的化合价为a价,根据电子转移守恒计算a的值.
解答:令X元素在产物中的化合价为a价,根据电子转移守恒,则:
30×10-3L×0.05mol/L×(6-4)=50×10-3L×0.02mol/L×(7-a)
解得a=+4
故选:C.
点评:考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键.熟练掌握电子转移守恒思想的运用.
本题难度:一般