1、选择题 下列溶液能与镁反应生成氢气的是
A.氯化铵溶液
B.氢氧化钠溶液
C.碳酸钾溶液
D.饱和石灰水
参考答案:A
本题解析:分析:金属镁的金属强较强,可以和酸或是水解显酸性的盐溶液反应生成氢气.
解答:A、氯化铵中的铵根离子水解显酸性,可以和金属镁反应产生氢气,故A正确;
B、氢氧化钠和金属镁不反应,故B错误;
C、碳酸钠溶液中碳酸根离子水解显碱性,不能和金属镁反应,故C错误;
D、饱和石灰水显碱性,不与金属镁反应,故D错误;
故选A.
点评:本题考查学生金属镁的化学性质,由于盐中某些离子的水解导致盐溶液有的不再显中性是解此题的关键,难度不大.
本题难度:一般
2、选择题 工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充水,也无多余的水分,所用硫酸溶液溶质的质量分数应为
A.45.8%
B.57.6%
C.72.3%
D.无法确定
参考答案:B
本题解析:本题考查计算能力,试题难度中等;根据题意,制备过程中既不补充水,也无多余的水分,故CuSO4·5H2O中的水来自反应生成的水和硫酸溶液中的水,1molCuSO4·5H2O中含有5mol结晶水,其中有1mol来自CuO和H2SO4反应,故硫酸溶液中的水为4mol,所以硫酸溶液的质量分数为:×100%=57.6%
本题难度:一般
3、选择题 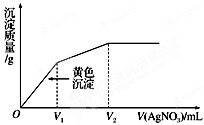 往含KI和KCl的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则下列说法正确的是
往含KI和KCl的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则下列说法正确的是
A.原溶液中?等于
B.原溶液中?等于
C.V2时取上层清液做焰色反应火焰呈黄色
D.V2时生成沉淀的总物质的量与加入AgNO3的总物质的量相等
参考答案:BD
本题解析:分析:AB、由图象可知,先生成碘化银沉淀后生成氯化银沉淀,根据图象中沉淀的拐点可知沉淀完全需硝酸银的体积,根据n=cV计算各阶段消耗n(AgNO3),根据发生反应:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓判断原溶液中n(I-)、n(Cl-),据此判断;
C、V2时上层清液溶质为KNO3,焰色反应火焰呈紫色;
D、V2时生成沉淀的总物质的量为n(AgI)+n(AgCl),根据银离子守恒判断.
解答:A、由图象可知,先生成碘化银沉淀后生成氯化银沉淀,加入V1体积硝酸银,碘离子沉淀完全,则n(I-)=c(AgNO3)×V1,加入V2体积的硝酸银,氯离子沉淀完全,则n(Cl-)=c(AgNO3)×(V2-V1),体积相同,浓度之比等于物质的量之比,所以原溶液中原溶液中? =
=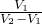 ,故A错误;
,故A错误;
B、由A分析可知,原溶液中原溶液中? =
=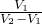 ,故B正确;
,故B正确;
C、V2时上层清液溶质为KNO3,焰色反应火焰呈紫色,故C错误;
D、V2时生成沉淀的总物质的量为n(AgI)+n(AgCl)=c(AgNO3)×V1+c(AgNO3)×(V2-V1)=c(AgNO3)×V2,故D正确;
故选BD.
点评:本题考查了沉淀溶解平衡、混合物的有关计算等,从图象中判断碘离子先沉淀、氯离子后沉淀是解题的关键,难度中等.
本题难度:一般
4、选择题 碱金属元素是周期性表现得最鲜明和最规律的一族元素。下列说法正确的是
A.碱金属单质中锂的密度最小,熔点最低
B.碳酸钾溶液的pH<7
C.乙醇与金属钾反应生成氢气
D.用电解铯盐溶液的方法冶炼金属铯
参考答案:C
本题解析:碱金属单质从上而下密度增大,熔点降低,故Li的密度最小,熔点最高,A项错;Li2CO3属于强碱弱酸盐,水解使溶液显碱性,pH>7,不选B;C项反应为:2C2H5OH+2K 2C2H5OK+H2↑。电解铯盐溶液时,由于氧化性H+>Cs+,故不产生金属铯,不选D,可用电解熔融无水铯盐的方式获得金属铯。
2C2H5OK+H2↑。电解铯盐溶液时,由于氧化性H+>Cs+,故不产生金属铯,不选D,可用电解熔融无水铯盐的方式获得金属铯。
本题难度:一般
5、选择题 在以下物质间的多步转化过程中,其中含有不能通过一步反应实现的是
A.Fe→FeCl2→Fe(OH)2→Fe(OH)3
B.Al→Al2O3→Al(OH)3→NaAlO2
C.S→SO2→H2SO4→MgSO4
D.N2→NO→NO2→HNO3
参考答案:B
本题解析:分析:A、铁和盐酸反应生成氯化亚铁,再和烧碱反应可得氢氧化亚铁,进而被氧气氧化为氢氧化铁;
B、铝在氧气中反应生成氧化铝,氧化铝不溶于水,不能生成氢氧化铝,氢氧化铝能和烧碱反应生成偏铝酸钠盐;
C、硫和氧气生成二氧化硫,二氧化硫可以一步生成硫酸,硫酸和镁反应生成硫酸镁;
D、氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮;
解答:A、Fe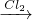 FeCl2
FeCl2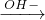 Fe(OH)2
Fe(OH)2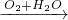 Fe(OH)3,可以一步实现,故A不符合;
Fe(OH)3,可以一步实现,故A不符合;
B、Al Al2O3→不能一步实现转化为氢氧化铝;Al(OH)3
Al2O3→不能一步实现转化为氢氧化铝;Al(OH)3 NaAlO2,故B符合;
NaAlO2,故B符合;
C、S SO2→
SO2→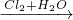 H2SO4
H2SO4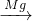 MgSO4,故C不符合;
MgSO4,故C不符合;
D、N2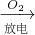 NO
NO NO2
NO2 HNO3,故D不符合;
HNO3,故D不符合;
故选B.
点评:本题涉及物质之间的转化知识,可以根据所学的知识来回答,明确物质的性质是解答本题的关键.
本题难度:简单