1、选择题 a?gMg-Al合金完全溶解在c1?mol/L、V1LHCl溶液中,产生bmolH2.再向反应后的溶液中加入c2mol/L、V2LHCl溶液,恰好使沉淀达到最大值,且沉淀质量为dg.下列关系不正确的是
A.d=a+34b
B.c1V1=c2V2
C.Al的质量g
D.与金属反应后剩余HCl为(c1V1-2b)mol
参考答案:C
本题解析:分析:A、根据金属、氢气和沉淀之间的关系式得沉淀质量=金属质量+氢氧根质量.
B、根据恰好使沉淀达到最大值,且沉淀质量为dg.反应后溶液的成分为NaCl,根据酸和碱以1:1反应判断酸和碱的物质的量之间的关系.
C、设合金中含有xmolMg,ymolAl,根据生成氢气的物质的量和金属的质量可列方程组计算合金中镁和铝的物质的量,根据镁和铝的物质的量金属其质量;
D、总盐酸的物质的量减去生成氢气所用盐酸的物质的量即为剩余盐酸的物质的量.
解答:设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生b?mol?H2,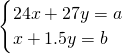 ,所以
,所以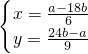 .
.
A、再向反应后的溶液中加入C2mol?L-1、V2L?NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg,
根据Mg~H2~Mg(OH)2,Al~1.5H2~Al(OH)3,反应生成沉淀的质量等于金属的质量加氢氧根离子的质量,而氢氧根离子的物质的量等于2n(H2),则d=a+2b×17=a+34b,故A正确.
B、反应后溶液的成分为NaCl,则C1×V1=C2×V2,故B正确.
C、铝的质量为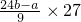 =3(24b-a)g,故C错误.
=3(24b-a)g,故C错误.
D、生成bmolH2,则消耗盐酸2bmol,则剩余HCl为(c1V1-2b)mol,故D正确.
故选C.
点评:本题考查混合物的计算,题目难度较大,本题利用守恒的方法计算.
本题难度:困难
2、选择题 有一瓶Na2SO3溶液,可能部分被氧化.某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀HNO3,充分振荡后仍有白色沉淀,对此实验下列结论正确的是
A.Na2SO3已部分氧化
B.加入硝酸钡溶液生成的沉淀一定含BaSO4
C.加入HNO3后的不溶沉淀一定为BaSO3
D.此实验不能确定Na2SO3是否部分氧化
参考答案:D
本题解析:
本题难度:一般
3、选择题 将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是
A.漂白粉;
B.过氧化钠;
C.硝酸锌;
D.氧化铜
参考答案:D
本题解析:铁与盐酸反应生成二价铁,要变成三价铁,必须加入氧化剂。漂白粉和过氧化钠均具有与强氧化性,硝酸根遇到氢离子也具有强氧化性。Cu2+的氧化性比Fe3+弱,故不行。
本题难度:困难
4、选择题 下列变化需要加入氧化剂才能实现的是
A.CaCO3→CO2
B.KMnO4→O2
C.HCl→Cl2
D.H2SO4→H2
参考答案:C
本题解析:分析:需要加入氧化剂才能实现,则选项中应为还原剂的反应,还原剂中某元素的化合价升高,以此来解答.
解答:A.CaCO3→CO2中元素的化合价没有变化,则不需发生氧化还原反应,故A不选;
B.KMnO4→O2中O元素的化合价升高,发生氧化还原反应,但不需要加氧化剂,加热分解即可实现,故B不选;
C.HCl→Cl2中Cl元素的化合价升高,则需要加氧化剂才能发生,故C选;
D.H2SO4→H2中H元素的化合价降低,则需要加还原剂才能发生,故D不选;
故选C.
点评:本题考查氧化还原反应,明确氧化剂、还原剂中元素的化合价变化即可解答,难度不大.
本题难度:简单
5、选择题 Fe、CO、CuO、NaOH溶液、Na2CO3溶液、Ba(OH)2溶液、稀H2SO4七种物质,在常温下两种物质间能发生的化学反应有
A.4个
B.5个
C.6个
D.7个
参考答案:D
本题解析:分析:依据各物质所属物质类别,根据化学性质逐一进行分析得到结果;金属氧化物可以与酸反应生成盐和水,酸碱盐之间要发生复分解反应需符合复分解反应的条件,即生成物中有水、沉淀或气体生成.金属可以和酸反应生成盐和水等.
解答:铁能和硫酸反应生成硫酸亚铁和氢气,
一氧化碳和氧化铜反应生成铜和二氧化碳,
氧化铜和硫酸反应生成硫酸铜和水,
氢氧化钠和硫酸反应生成硫酸钠和水,
碳酸钠能和氢氧化钡溶液反应生成碳酸钡沉淀,还能和硫酸反应生成二氧化碳气体,
氢氧化钡还能和硫酸反应生成硫酸钡沉淀,
故一共发生七个反应;
故选D.
点评:本题考查了各类物质的性质应用,此类题的解法可归纳为:先分类,后碰头.即根据物质的组成把物质分为金属,酸碱盐,氧化物等,然后从左向右依次将两物质碰头,根据反应规律判断能否反应,最后得出答案.
本题难度:困难