1、选择题 下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是(?)
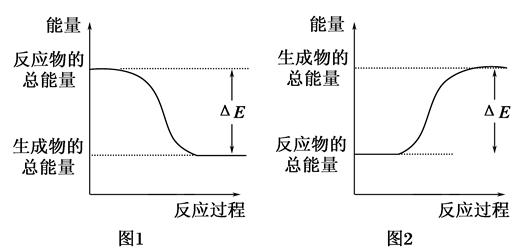
A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ
B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ
C.发生图1能量变化的任何反应,一定不需加热即可发生
D.CaO、浓硫酸溶于水时的能量变化符合图1
参考答案:A
本题解析:图1表示放热反应,图2表示吸热反应。选项B是放热反应,故错误;选项A,1mol H+与1mol OH-反应放出57.3kJ热量,正确;选项C,一些放热反应需加热才能发生,故错误;选项D,浓硫酸溶于水虽然会放出热量,但不属于化学反应,故错误。
本题难度:一般
2、选择题 下列有关能量转化的理解不正确的是
[? ]
A.现在使用的各项照明设备是将电能转化为光能
B.燃料的燃烧过程只是将蕴藏的化学能转化为热能
C.风能是太阳能的一种转换形式,风能可以再转化为电能
D.生物体内的生物化学过程的能量转化在“能源”利用上更为合理、有效
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列说法正确的是( )
A.H2(g)的燃烧热△H=-285.8?kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6?kJ/mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0
D.已知:298?K时,N2(g)+3H2(g)?2NH3(g)△H=-92.0?kJ/mol.在相同温度下,向密闭容器中通入0.5?mol?N2和1.5?mol?H2,达到平衡时放出46.0?kJ的热量
参考答案:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,则2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ/mol,故A错误;
B、反应物的总能量低于生成物的总能量时,该反应为吸热反应,故B错误;
C、石墨比金刚石稳定,所以石墨具有的能量低,C(金刚石,s)=C(石墨,s)△H<0,故C正确;
D、向密闭容器中通入0.5?mol?N2和1.5?mol?H2,达到平衡时放出的热量小于46.0?kJ,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列图示变化为吸热反应的是

参考答案:A
本题解析:A中反应物的总能量低于生成物的总能量,则反应是吸热反应;B中反应物的总能量高于生成物的总能量,反应是放热反应;C中是浓硫酸的稀释是放热过程,但属于物理变化;D中是放热反应,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对常见放热反应和吸热反应的了解情况,意在巩固学生的基础知识,提高学生的应试能力。该题的关键是记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。
本题难度:一般
5、选择题 下列说法中正确的是(?)?
A.伴有能量变化的物质变化都是化学变化
B.物质发生化学反应一定伴随着能量变化
C.吸热反应在常温下不能发生
D.放热反应的发生无需任何条件
参考答案:B
本题解析:A.化学变化通常都伴有能量变化,但是伴有能量的物质变化不一定是化学变化。如物质的状态的变化是物理变化,有热量的放出或吸收。错误。B.物质发生化学反应时要断裂化学键,这需要吸收能量,产生生成物时要形成化学键,这时又释放能量。因此化学变化中一定伴随着能量变化。正确。C.有些吸热反应在常温下也能发生。错误。D.放热反应也要在一定的条件下才能进行,因此发生需要在一定的条件。错误。
本题难度:一般