1、选择题 下列有关化学能与热能的说法正确的是?
A.铝热反应属于吸热反应
B.H2→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.若某反应生成物的总能量大于反应物的总能量,则该反应为放热反应
参考答案:B
本题解析:铝热反应发生时需加热到一定温度,但它过程中释放大量热量,属于放热反应,A、C错;破坏化学键,需要吸收能量,B正确;若某反应生成物的总能量大于反应物的总能量,则该反应为吸热反应,D错。
点评:判断一个反应为吸热反应或放热反应,是历年高考的常考题型,考生可根据反应基本类型进行判断,并注意积累特殊的化学反应的反应热。
本题难度:一般
2、选择题 在298K、100kPa时,已知:

则⊿H3与⊿H1和⊿H2间的关系正确的是(? )
A.△H3=△H1 + 2 △H2
B.△H3=△H1+△H2
C.△H3=△H1 - 2 △H2
D.△H3=△H1-△H2
参考答案:A
本题解析:考查盖斯定律的应用。根据已知反应可知,①+②×2即得到③,所以反应热就是△H3=△H1 + 2 △H2,答案选A。
本题难度:简单
3、推断题 (14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
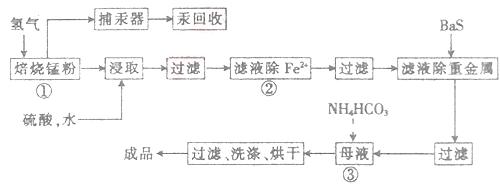
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:
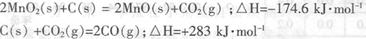
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
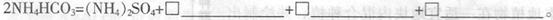
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
参考答案:28.(14分)(1)用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物(2分)
(2)MnO2(s)+C(s) = MnO(s)+CO(g)?△H=+54.2kJ·mol-1?(3分)
(3)1; MnCO3↓;1;H2O;1;CO2↑(全对给2分)
(4)H2O2(或其他氧化剂)(2分);? 3.7~8.6(2分)
(5)Mn2++ 2 H2O -2e-= MnO2 +4H+(3分)
本题解析:(1)该流程中用硫酸浸取的时候可以生成氢气;(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;(4)将
Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,故需加入双氧水,还原为水,不引入新的杂质,控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,故需控制pH为3.7~8.6;(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子。
本题难度:一般
4、选择题 下列对化学反应的认识,错误的是?( )
A.会引起化学键的变化
B.会产生新物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
参考答案:A.化学反应必定会引起化学键的变化,故A正确;
B.化学变化是指有新物质生成的变化,会产生新物质,故B正确;
C.化学反应不一定引起物质状态的变化,如氢气与氯气反应生成氯化氢,都是气体,故C错误;
D.化学反应必然伴随着能量的变化,故D正确.
故选C.
本题解析:
本题难度:简单
5、选择题 H—H键的键能是436 kJ·mol -1,I—I键的键能是151 kJ·mol -1,H—I键的键能是299 kJ·mol -1。则对反应H2(g)+I2(g)  2HI(g)的说法,不正确的是?(?)
2HI(g)的说法,不正确的是?(?)
A.吸热反应
B.放热反应
C.化合反应
D.可逆反应
参考答案:B
本题解析:反应热=断裂化学键吸收的总能量-形成化学键放出的总能量;旧键断裂吸热:436 kJ·mol -1+151 kJ·mol -1="587" kJ·mol -1;新键形成放热:2×299 kJ·mol -1?,放热多表现为放热反应。
本题难度:简单