1、选择题 硫-钠原电池具有输出功率较高,循环寿命长等优点。其工作原理可表示为:2Na+xS Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(
Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(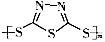 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
A.多硫化合物(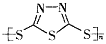 )是一种新型无机非金属材料
)是一种新型无机非金属材料
B.多硫化合物( )化合物不能发生加成反应
)化合物不能发生加成反应
C.原电池的负极反应是将单体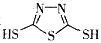 转化为
转化为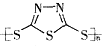 的过程
的过程
D.当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g
参考答案:D
本题解析:A选项,多硫化合物是一种聚合物,属于高分子材料,故A错误;B选项,此多硫化合物中含有不饱和键,能发生加成反应,故B错误;C选项根据电池反应可知原电池的负极是金属钠发生失电子的氧化反应,故C错误;D选项根据电极反应式:每消耗2 mol的金属钠,电子转移2 mol,当电路中转移0.02 mol电子时,将消耗原电池的负极反应原料0.46 g,故D正确,答案选D。
本题难度:一般
2、选择题 根据下列实验现象,所得结论正确的是
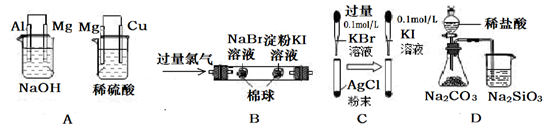
实验
| 实验现象
| 结论
|
A
| 左边烧杯中镁表面有气泡,右边烧杯中铜表面有气泡
| 还原性: Al>Mg>Cu
|
B
| 左边棉花变为橙色,右边棉花变为蓝色
| 氧化性:Cl2>Br2>I2
|
C
| 试管中白色固体先变淡黄色,后变为黄色
| 沉淀转化的实质就是沉淀溶解平衡的移动
|
D
| 锥形瓶中有气体产生,烧杯中溶液变浑浊
| 非金属性:Cl>C>Si
|
参考答案:C
本题解析:A中左边烧杯中铝可以与NaOH溶液反应,故铝做负极,镁作正极表面有气泡,右边烧杯中,镁可以与稀硫酸反应,镁做负极,铜做正极,铜表面有气泡,实验现象正确,但结论错误,比较时所用的试剂不同而得出了错误的结论,A错;左边棉花变为橙色可以说明氧化性:Cl2>Br2,但右边棉花变为蓝色不能确定是溴与KI发生了反应,有可能是Cl2与KI发生了反应,B错;向白色沉淀的溶液中再加入过量KBr溶液,再滴入KI,白色沉淀先变淡黄色后变黄色,说明沉淀发生转化,一定是平衡移动的结果,C对;要通过比较非金属形成的酸的酸性强弱来比较非金属性的强弱的话,一定要比较最高价含氧酸的酸性强弱,盐酸不是Cl的最高价含氧酸,D错。选C。
考点:金属性、非金属性的强弱的比较断,沉淀溶解平衡的应用。
本题难度:困难
3、选择题 有关下列图像说法正确的是(?)
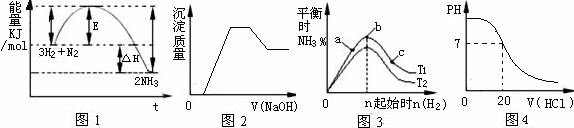
A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小
B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系
C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响。可知反应物N2的转化率最高的是b点;T1>T2,K2> K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数)
D.图4表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水的pH随加入盐酸体积的变化
参考答案:B
本题解析:催化剂能改变活化能,但不能改变反应热,A不正确;选项B中根据图像可知,增大氢气的浓度,平衡向正反应方向移动,因此氮气的转化率增大,所以氮气转化率最高的不受b点,C不正确;氨水是弱碱,因此恰好反应时,溶液显酸性,选项D不正确,所以正确的答案选B。
本题难度:一般
4、选择题 有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为:2H2+O2===2H2O,负极反应为H2+CO-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
A.正极反应为2H2O+O2+4e-===4OH-
B.常温常压下每消耗22.4LH2向外电路提供的电子小于2mol
C.电子由正极经外电路流向负极
D.电池中CO的物质的量将逐渐减少
参考答案:B
本题解析:总反应式减去负极的即得到正极反应式,A不正确。原电池中电子从负极流向正极,C不正确。根据总反应式可判断,CO的物质的量是不变的,D不正确。常温常压下22.4LH2的物质的量小于1mol,所以选项B是正确的。答案选B。
本题难度:一般
5、选择题 如图,一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH溶液。该电池负极的反应式:Zn -2e-+ 2OH-=ZnO+ H2O,总反应式为:Zn+ Ag2O=ZnO+ 2Ag。根据以上提供的资料,判断下列说法正确的是

[? ]
A.正极的反应式:Ag2O+ 2e-+H2O=2Ag+ 2OH-
B.放电时负极附近溶液的 pH不变
C.放电时每消耗6.5 g Zn,转移电子0.1 mol
D.放电时溶液中阴离子向正极方向移动,阳离子向负极方向移动
参考答案:A
本题解析:
本题难度:一般