1、填空题 (6分)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3- Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
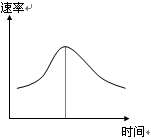
(1)反应开始时反应速率加快的原因是?;
(2)反应后期反应速率下降的原因是?。
参考答案:
(1)反应开始时c(H+)曾加,ClO3-的氧化性随c(H+)的增大而增强,化学反应速率加快;
(2)随着反应的进行,反应物的浓度降低化合反应速率减慢
本题解析:考查条件对反应速率的影响:浓度、温度、压强和催化剂等
(1)由题目所给信息可知,由于反应开始时生成了H+,ClO3-的氧化性随c(H+)的增大而增强,化学反应速率加快
(2)反应进行过程中,各反应物离子的浓度减小成为影响反应速率大小的主要因素,降低了反应速率
本题难度:简单
2、填空题 某密闭容器中有如下可逆反应:2SO2(g)+O2(g)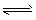 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
(1)升高温度,v(正)___________,v(逆)___________,SO2 的转化率_____________。
(2)加正催化剂,v(正)___________,v(逆)___________,O2 的物质的量___________。
(3)缩小容器的体积,SO3的物质的量___________,SO2的转化率______________。
参考答案:(1)增大;增大;减小
(2)增大;增大;不变
(3)增大;增大
本题解析:
本题难度:一般
3、选择题 下列说法不正确的是( )
A.反应物的分子的每次碰撞都能发生化学反应
B.反应物分子(或离子)间的每次碰撞是反应的先决条件
C.参加反应的物质的性质是决定化学反应速率的重要因素
D.活化分子具有比普通分子更高的能量
参考答案:A、反应物分子的每次碰撞不一定能发生化学反应,只有活化分子的有效碰撞才能发生化学反应,故A错误;
B、反应物分子间的每次碰撞是反应的先决条件,活化分子的有效碰撞是发生化学反应的充要条件,故B正确;
C、参加反应的物质的性质是决定化学反应速率的重要因素,温度、压强等影响化学反应速率的因素是次要因素,故C正确;
D、能够发生有效碰撞的分子是活化分子,活化分子具有比普通分子更高的能量,故D正确;
故选A.
本题解析:
本题难度:简单
4、选择题 在2A+B?3C+4D中,表示该反应速率最快的是( )
A.υ(A)=0.5mol?L-1?min-1
B.υ(B)=0.2mol?L-1?min-1
C.υ(C)=0.015mol?L-1?s-1
D.υ(D)=1mol?L-1?min-1
参考答案:反应速率的单位相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快,
A、v(A)=0.5mol?L-1?min-1,A的化学计量数为2,故v(A)2=0.5mol?L-1?min-12=0.25mol/(L?min);
B、v(B)=0.2mol?L-1?min-1,B的化学计量数为1,故v(B)1=0.2mol?L-1?min-1;
C、v(C)=0.015mol?L-1?s-1=υ(C)=0.9mol?L-1?min-1,C的化学计量数为3,v(C)3=0.3mol?L-1?min-1;
D、v(D)=1mol?L-1?min-1,D的化学计量数为4,故v(D)4=0.25mol?L-1?min-1;
所以反应速率v(C)>v(A)=v(D)>v(B),
故选C.
本题解析:
本题难度:一般
5、选择题 对于反应:N2(g)+O2(g)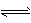 2NO(g),在密闭容器中进行,下列条件能加快其反应速率的是
2NO(g),在密闭容器中进行,下列条件能加快其反应速率的是
[? ]
A.缩小体积使压强增大
B.体积不变,充入N2使压强增大
C.体积不变,充入He使气体压强增大
D.总压强不变,充入Ne
参考答案:AB
本题解析:
本题难度:一般