1、简答题 (10分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) ?CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
?CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是___________ ,该时间段内H2的平均反应速率是_____________。
(2)平衡时CO2的转化率是多少?反应前后容器内的压强比时多少?(请按计算题格式在答题卡上作答)
L)
参考答案:(1)0~a段;该时间段内H2的平均反应速率是1mol/(L·min)?(2)33% ;7︰5
本题解析:(1)0~a段:V(H2)="(8mol-6mol)÷2L÷1min=1mol/(L·min);" a~b段:V(H2)="(6mol-3mol)÷" 2L÷ 2min="0.75mol/(L·min);" b~c段:V(H2)="(3mol-2mol)÷2L÷5min=0.1mol/(L·min);" c~d段:V(H2)="(2" mol- 2mol)÷2L÷5min0=0.1mol/(L·min)。所以平均反应速率最大的时间段是0~a段。该时间段内H2的平均反应速率是1mol/(L·min)。(2) 在反应过程中H2的物质的量改变6mol,因为CO2与H2反应的物质的量的比为1:3,所以CO2反应消耗的物质的量为2mol.因此平衡时CO2的转化率是(2mol÷6molCO2) ×100%= 33%。反应前后容器内的压强比等于气体的物质的量的比。在反应开始时,n(总)=6+8=14mol;当反应达到平衡时,n(H2)=2mol;n(CO2)=(6-2)mol=4mol;n(CH3OH)=2mol;n(H2O)= 2mol。所以n(总)平衡=10mol.n(开始):n(平衡)=14:10=7︰5。所以反应前后容器内的压强比7︰5。
本题难度:一般
2、选择题 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体?②H2O?③NaNO3溶液?④CH3COONa固体?⑤KCl溶液.
A.①②
B.②④⑤
C.②③⑤
D.②③④
参考答案:Fe与盐酸反应的实质为Fe+2H+═Fe2++H2↑,为了减缓反应速度,且不影响生成氢气的总量,则可减小氢离子的浓度,但不改变氢离子的物质的量,
①加入NaOH固体,氢离子的物质的量及浓度均减小,故①错误;
②加入H2O,减小氢离子的浓度,但不改变氢离子的物质的量,故②正确;?
③NaNO3溶液,酸性条件下,硝酸根具有强氧化性,与铁反应不能产生氢气,减少了氢气的生成量,故③错误;?
④加入CH3COONa固体与盐酸反应生成弱酸,减小氢离子的浓度,但不改变氢离子的物质的量,故④正确;
⑤加入KCl溶液,相当于加水稀释,减小氢离子的浓度,但不改变氢离子的物质的量,故⑤正确;?
显然②④⑤正确,
故选B.
本题解析:
本题难度:一般
3、选择题 反应:X(g) + 3Y(g)  ?2Z(g) ;△H﹤0。在不同温度T、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为
?2Z(g) ;△H﹤0。在不同温度T、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为
参考答案:C
本题解析:略
本题难度:简单
4、选择题 一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
| 0
| t1
| t2
| t3
| t4
|
n(SO3)/mol
| 0
| 0.8
| 1.4
| 1.8
| 1.8
|
?
下列说法正确的是(?)
A.反应在前t1s的平均速率v(O2)=0.4/t1 mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
参考答案:D
本题解析:2SO2+O2 2SO3
2SO3
起始/mol? 2?1?0
平衡/mol? 2-2a?1-a? 2a
2a=1.8 mol?a=0.9 mol
A项,v(O2)= v(SO3)=
v(SO3)= ×
× =
=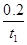 ?mol·L-1·s-1错误;B项,平衡常数只与温度有关,错误;C项,原平衡,SO2的转化率为
?mol·L-1·s-1错误;B项,平衡常数只与温度有关,错误;C项,原平衡,SO2的转化率为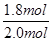 ×100%=90%,当向容器中充2 mol SO3时,SO3的转化率等于10%,当充入4 mol SO3,相当于加压,SO3的转化率减小,应小于10%,错误;D项,相当于缩小容器的体积,平衡右移,n(SO3)/n(O2)增大,正确。
×100%=90%,当向容器中充2 mol SO3时,SO3的转化率等于10%,当充入4 mol SO3,相当于加压,SO3的转化率减小,应小于10%,错误;D项,相当于缩小容器的体积,平衡右移,n(SO3)/n(O2)增大,正确。
本题难度:一般
5、选择题 温度为500℃时,反应4NH3+5O2 4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为(?)
4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为(?)
A.v(O2)=0.01mol/(L?s)
B.v(NO)=0.01mol/(L?s)
C.v(H2O)=0.006mol/(L?s)
D.v(NH3)=0.005mol/(L?s)
参考答案:D
本题解析:NO反应速率为0.3mol/2L?0.5min = 0.3mol/(L?min)= 0.005mol/(L?s),反应速率之比等于化学计量数之比。故选择D
本题难度:一般